冷冻保存与冻干保存的操作规程_03:冷冻保存原理、操作注意事项
来源:武汉市灰藻生物科技有限公司 浏览量:717 发布时间:2025-07-29 11:29:58
引言
# 本文译自国际权威著作《冷冻保存与冷冻协议(第二版)》(*Cryopreservation and Freeze-Drying Protocols, 2nd ed.*)第3章《冷冻保存原理》。
冷冻保存旨在利用超低温,长期维持细胞与组织的结构完整性和生物活性。然而,冷冻过程本身若不加控制,常因水的冻结引发致命损伤。损伤机制主要涉及两种理论:冰晶机械损伤与溶液效应(溶质浓缩)。
冷冻保护剂(如甘油、DMSO等)通过减少冰晶形成和渗透细胞发挥保护作用,但其应用需平衡生物相容性与毒性。细胞存活率高度依赖降温速率和复温速率,其最优值需规避细胞内结冰风险,同时最小化高浓度溶质或脱水造成的损伤;在特定条件下,细胞外冰晶也可能导致机械损伤。玻璃化作为一种避免冰晶形成的替代途径,面临冷冻保护剂毒性的挑战。值得注意的是,无论是常规冷冻还是玻璃化,冷冻保护剂的渗透以及伴随的扩散与渗透过程,贯穿于保护剂的添加、去除、冷冻和解冻全流程,对细胞体积变化和最终存活至关重要。深入理解这些机制,是开发适用于细胞乃至复杂组织的有效冷冻保存方法、并推动其在生物学与医学领域广泛应用的基础。
摘要
冷冻保存(Cryopreservation)是指利用极低温来保存结构完整、具有活性的细胞(cells)和组织(tissues)的技术。在没有保护措施的情况下,冷冻过程通常会对生物体造成致命损伤。本章旨在分析冷冻过程中涉及的一些关键机制,并探讨如何通过控制降温过程,创造稳定条件以实现生命的长期保存。
冷却对生物系统的影响主要源于水的冻结(freezing of water),而冻结过程会导致残余液相中溶解的溶质(solutes)浓度显著升高。关于冷冻损伤(freezing injury)的机制,存在两种相互竞争的理论:一种认为冰晶(ice crystals)通过机械作用穿透或“撕裂”细胞,从而破坏细胞结构;另一种则认为损伤来源于液相成分变化所引发的次级效应(secondary effects),即所谓的“溶液效应”(solution effects)。
冷冻保护剂(cryoprotectants)通过增加体系中所有溶质的总浓度,从而在特定温度下减少冰晶的形成;但为了具备生物相容性(biological acceptability),它们还必须能够穿透细胞膜,并具有较低的毒性(low toxicity)。许多化合物具备这些特性,包括甘油(glycerol)、二甲基亚砜(dimethyl sulfoxide, DMSO)、乙二醇(ethanediol)、丙二醇(propanediol)等。
两种损伤机制的相对作用,取决于细胞类型、降温速率(cooling rate)以及复温速率(warming rate)。目前学界普遍认为,细胞内结冰(intracellular freezing)是危险的,而细胞外结冰(extracellular ice formation)通常被认为是无害的。如果已知细胞膜的水通透性(water permeability),则可以预测降温速率对细胞存活率的影响,而最优降温速率则是在细胞内结冰风险与浓缩溶质带来的毒性或脱水效应之间取得平衡。
胞外冰晶并非总是无害,在细胞密集排列的情况下,细胞更容易因被隔离在冰晶形成的通道中而受到机械应力(mechanical stresses)的损伤;在复杂的多细胞系统(multicellular systems)中,不仅要确保细胞存活,还必须避免对细胞外结构(extracellular structure)的破坏。
冰晶形成可以通过玻璃化(vitrification)来避免,即通过形成一种高黏度(通常达到约10¹³泊)的非晶态固体,即玻璃态(glassy state),而不发生结晶。然而,玻璃化方法面临的主要问题是冷冻保护剂的毒性问题。
无论是常规冷冻保存(conventional cryopreservation),还是阻止结冰的玻璃化保存(vitrification),冷冻保护剂都必须能够渗透到整个系统。然而,溶质的自由扩散存在诸多障碍(如细胞膜),这可能导致不同隔室(compartments)体积的暂时性变化,甚至达到平衡状态时的变化,而这些变化可能对细胞造成损伤。
因此,在冷冻保护剂的引入(introduction)、去除(removal)、冷冻(freezing)及解冻过程(thawing)中,扩散(diffusion)和渗透(osmosis)作用都具有重要影响。这些现象可通过实验研究和分析,开发出适用于多种细胞以及组织的有效保存方法,在生物学(biology)和医学(medicine)领域得到了广泛应用。
关键词:冷冻保存(Cryopreservation);冷冻保护剂(cryoprotectants);细胞内结冰(intracellular freezing);溶液效应(solution effects);过冷(supercooling);玻璃化(vitrification)
1. 冷冻损伤与冷冻保护
1.1 甘油的冷冻保护作用的发现
科幻作家长期以来一直被“暂停生命”(suspended animation)这一概念所吸引,即生命的生物化学过程可以被暂停很长时间,随后再恢复。尽管这种现象在自然界中确实存在,但极为罕见。遗憾的是,冷冻(freezing)通常对生物体是致命的。为了理解极低温的影响,必须认识到许多结构和过程都具有温度依赖性(temperature dependent),因此降温会带来极其复杂的效应,这些效应远远偏离正常的生理状态。
当温度低于 0°C 时,生物学效应主要由水的冻结(freezing of water)所主导,而水通常占组织质量的至少 80%。冷冻(freezing)是指液态水转化为结晶态冰的过程,这会导致残余液相中溶解溶质(solutes)浓度升高,并使超过溶解度极限的溶质发生沉淀。
直到 1948 年,人们才首次发现了一种通用的方法,可以实现多种动物细胞的冷冻保存,并在解冻后恢复其结构和功能。1949 年,Polge、Smith 和 Parkes 发表了具有里程碑意义的论文(1),表明添加 10–20% 甘油(glycerol)可以使公鸡精子(spermatozoa),在 –80°C 下长期冷冻后仍能存活。
当时关于冷冻损伤(freezing injury)的主流理论认为,冰晶(ice crystals)通过穿透或“撕裂”细胞结构,以机械作用破坏细胞。甘油通过增加总溶质浓度,从而减少冰晶的形成,其作用方式类似于汽车发动机冷却系统中使用的防冻剂(antifreeze,如乙二醇 ethanediol)。
然而,人们很快意识到,冷冻水溶液的另一个效应是:随着液相体积的减少,剩余溶液中溶质的浓度会升高,而这可能是细胞损伤的根本原因之一。在 1950 年代发表的一系列经典论文中,James Lovelock(2,3)提供了有力证据,表明盐浓度升高(而不是冰的形成)才是导致细胞冷冻损伤的主要原因,而甘油的保护作用仅体现在它能够调节冷冻过程中盐浓度的上升。
由此可以推断,冷冻保护剂(cryoprotectant)的有效性,取决于以下特性:
• 在水中高度可溶,在低温下仍能保持溶解,以显著降低冰点(freezing point depression);
• 能够穿透细胞膜(cell membrane);
• 具有较低的毒性(low toxicity),以便在高浓度下使用。
目前常用的包括,甘油(glycerol)、二甲基亚砜(dimethyl sulfoxide, DMSO)、乙二醇(ethanediol)和丙二醇(propanediol)。
1.2 温度变化速率的影响
上述理论为冻存(cryopreservation)技术发展提供了起点,但很快人们发现实际情况更为复杂。
首先,降温速率(cooling rate),随后是复温速率(warming rate),被发现是影响细胞存活的重要决定因素,而 Lovelock 的理论并未解释这种动力学效应。
1963 年,Mazur 发现温度变化速率之所以重要,是因为它控制了水通过细胞膜的转运速率,从而间接影响细胞内结冰(intracellular freezing)(4)。一般而言,细胞内结冰是致命的。
Mazur 指出,降温速率控制着水转化为冰的速度,也控制着溶液浓度的变化速度。通过调节周围液体的渗透浓度(osmolality),温度变化速率也影响了冷却过程中,水从细胞内部流出,以及复温过程中水流入细胞的速率。
如果水能够迅速离开细胞,以维持细胞膜两侧的热力学平衡,那么细胞质(cytoplasm)就不会冷却到冰点以下(即不会发生过冷(supercooling)),形成的冰都将位于细胞外部。
然而,如果降温速率过快,导致细胞膜无法将足够的水排出细胞,则细胞质将发生过冷,且过冷程度越高,细胞发生内部结冰(internal freezing)的可能性就越大(见图1)。
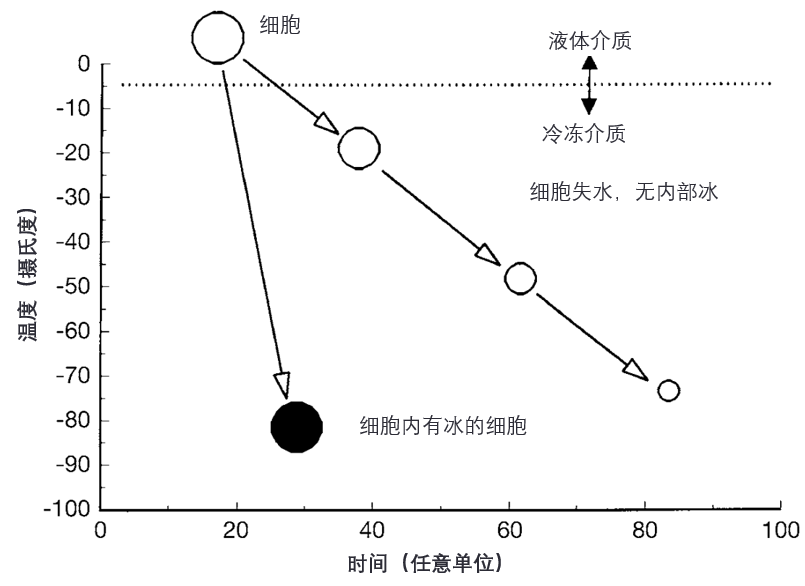
图1. 快速降温时细胞的示意图:水来不及排出导致细胞内结冰(intracellular freezing),或降温足够缓慢使细胞失水从而避免细胞内冰晶形成。
溶液效应与胞内去冰共同作用,使得细胞在特定的降温速率下,具有最高的存活率。随着降温速率增加,高盐浓度对细胞的有害作用被削弱;但一旦降温过快,细胞内结冰发生,存活率又会下降。
每种细胞都有其最佳降温速率(optimum cooling rate)(见图2),不过,除非存在冷冻保护剂来减少低温下细胞的损伤,否则绝对存活率通常极低。
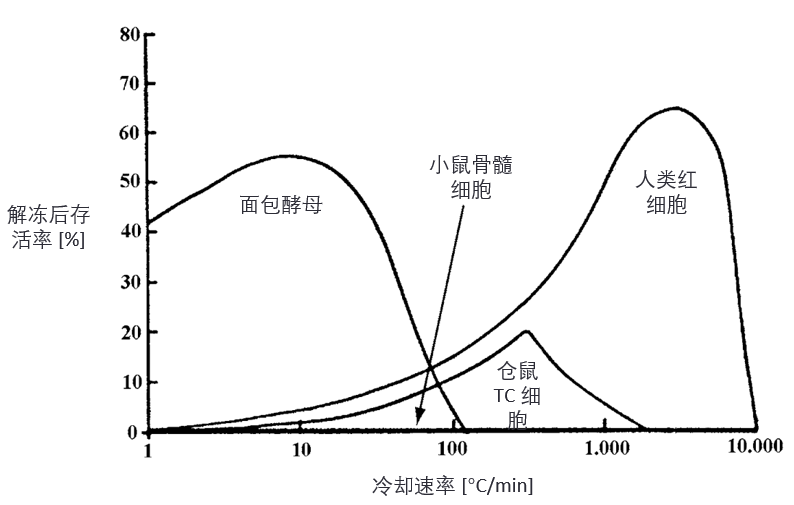
图2. 冷却速率(cooling rate)对四种细胞冷冻后存活率的影响。(基于文献 5)
冷冻保护剂,如甘油,能够减轻溶液效应,从而降低最佳降温速率,并提高最大存活率(见图3)。
接下来我们将更详细地探讨冷冻损伤与冷冻保护的机制。
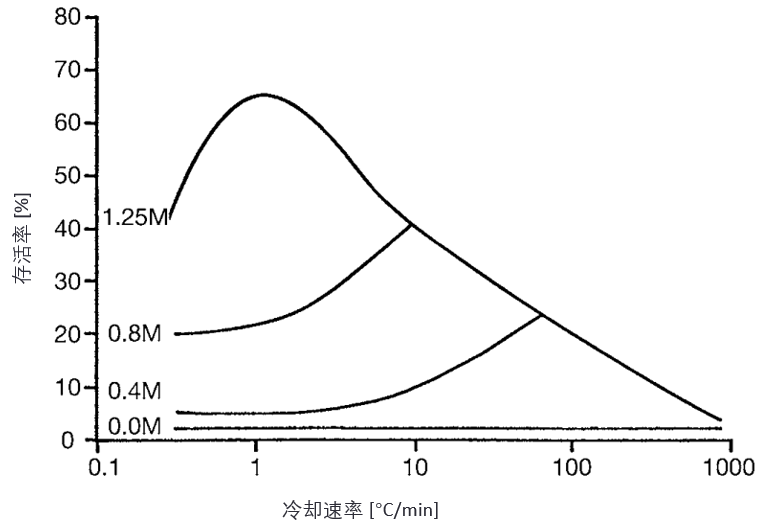
图3. 在不同摩尔浓度(molar concentrations)甘油(glycerol)存在下,小鼠造血干细胞(mouse hemopoietic stem cells)冷冻保存过程中冷却速率的影响。(经许可重印自文献 6)
1.3 溶液效应
Lovelock(2)曾证实,当红细胞(erythrocytes)悬浮于盐溶液中,冷却至某一亚零温度并解冻后,其溶血(hemolysis)程度与将细胞暴露于该温度下冷冻所形成的氯化钠浓度,然后返回等渗盐水时所造成的损伤相当(见图4)。
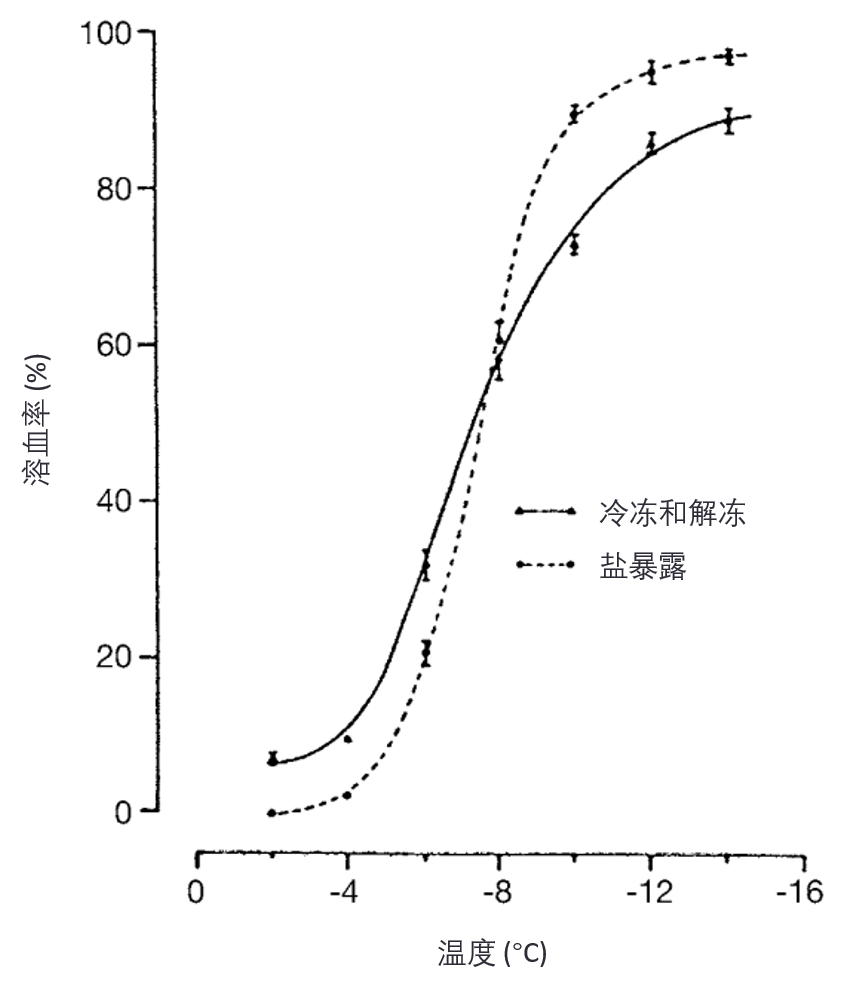
图4. 将人红细胞(human erythrocytes)冷冻至指定温度后解冻(三角形),与暴露于等效盐浓度后再恢复等渗条件(圆形)的比较。(经许可重印自文献 8)
Lovelock 还进一步证明(3),当甘油存在时,溶血开始的温度(较低)正好是相同盐浓度临界值形成时的温度(见图5)。相关性并不等于因果性,但在这种情况下,如果溶液成分变化不是导致冷冻损伤的原因,那么这种高度对应关系将是极其偶然的。
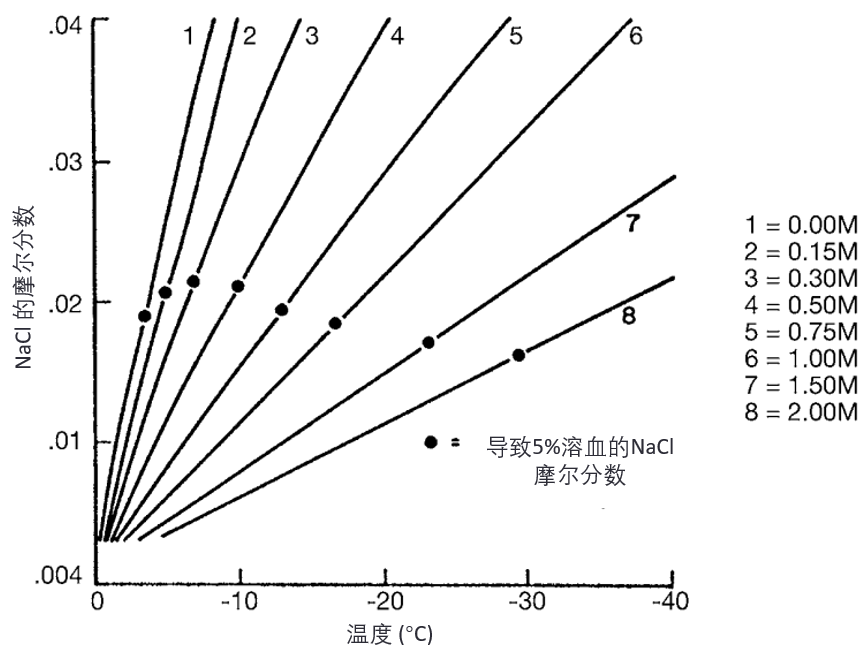
图5. 含有指定甘油(glycerol)摩尔浓度、且与 NaCl 等渗的溶液中,NaCl 的摩尔分数(mole fraction)变化。当 NaCl 的摩尔分数达到 0.016–0.021 时,观察到 5% 的溶血(hemolysis)。
细胞外冰晶(extracellular ice)本身对细胞无害,而冷冻损伤是由冰形成所引发的间接效应造成的。然而,悬浮介质中的盐并不是唯一被浓缩的溶质,冷冻保护剂(cryoprotectant)也会被同等程度地浓缩。
Pegg 和 Diaper(7)的研究显示,在甘油存在的情况下,红细胞暴露于相同盐浓度时受到的损伤,实际上比没有甘油时更严重,且这种效应与甘油的浓度有关(见图6)。当红细胞在不同浓度甘油存在下冷冻并解冻时,他们仍观察到盐暴露效应与冷冻效应之间的对应关系。
表明冷冻保护剂并非完全无害,虽然总体上它们具有保护作用,但代价是可能带来额外的损伤;另一方面,这一观察为溶液效应理论(solution-effect theory)提供了有力支持。
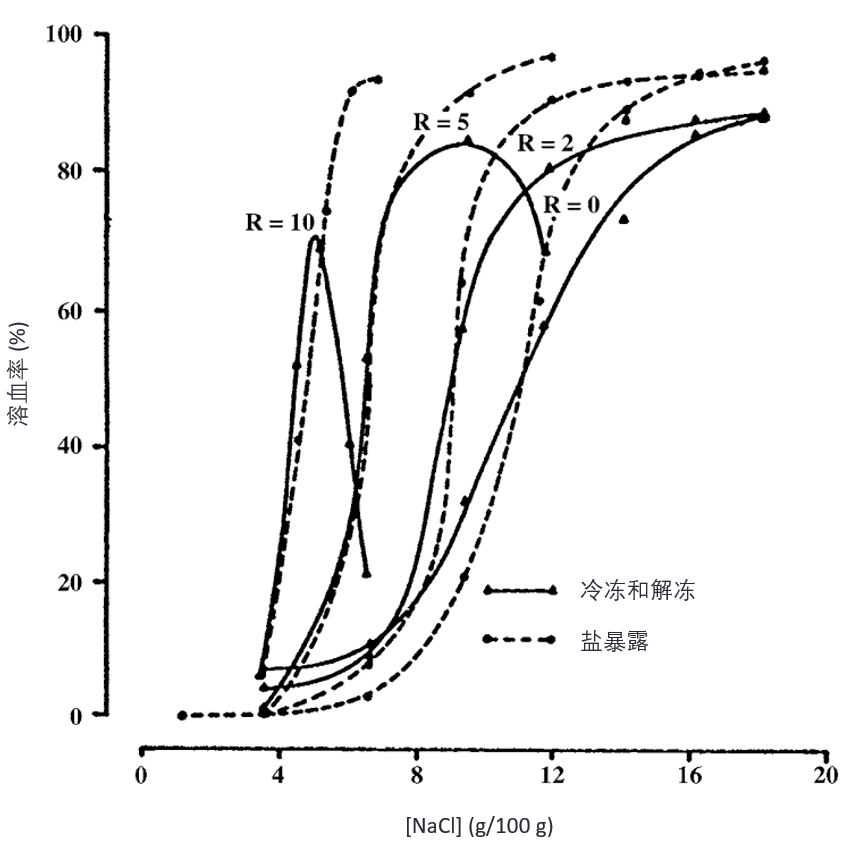
图6. 人红细胞(human erythrocytes)在产生指定 NaCl 浓度的温度下冷冻,与暴露于等效盐浓度后再恢复等渗条件下的溶血比较。R 值表示每种溶液中甘油(glycerol)与 NaCl 的质量比(weight ratio)。
1.4 胞内结冰
如果已知细胞膜的透水性(water permeability),并且可以估算其随温度变化的系数,可以预测降温速率对细胞存活的影响(见图7)。计算不同降温速率下的过冷程度表明,在 1°C/min 的降温速率下,细胞内结冰的可能性较低,而在 10°C/min 的速率下则高度可能。对于肝细胞(hepatocytes),约 1°C/min 的降温速率基本可以消除细胞内结冰的风险,只有在溶液效应成为问题时,才考虑更快的降温速率,最佳降温速率是这两者之间的权衡。
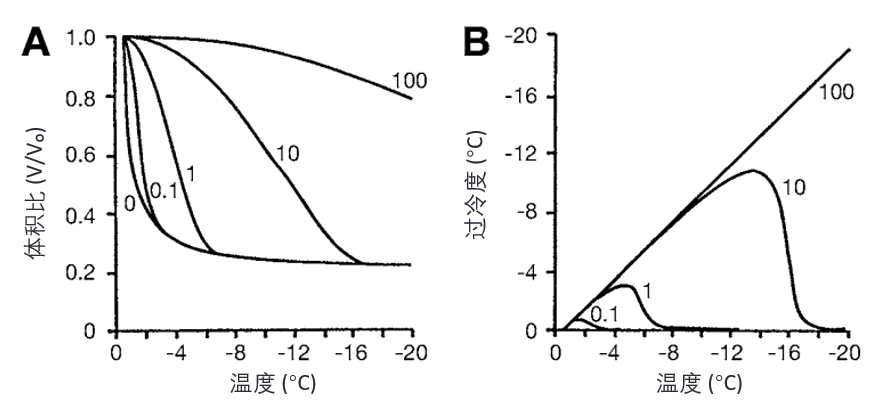
图7. 计算所得冷却速率(cooling rate)对肝细胞(hepatocytes)体积及其内容物过冷程度(supercooling)的影响。
(A) 在不同冷却速率(°C/min)下细胞的相对体积(v/v₀)。标为“0”的线表示平衡状态下的体积变化。
(B) 同 A 的计算结果,显示在不同冷却速率下细胞内容物的过冷程度。在 10°C/min 的冷却速率下,细胞内容物过冷约 10°C,因此很可能发生细胞内结冰(intracellular freezing)。
当然,不同细胞具有不同的水通透性,已有实验证明,在冷冻显微镜(cryomicroscope)下观察到的细胞内结冰所对应的降温速率,与导致显著细胞内过冷的降温速率是一致的([10];见图8)。
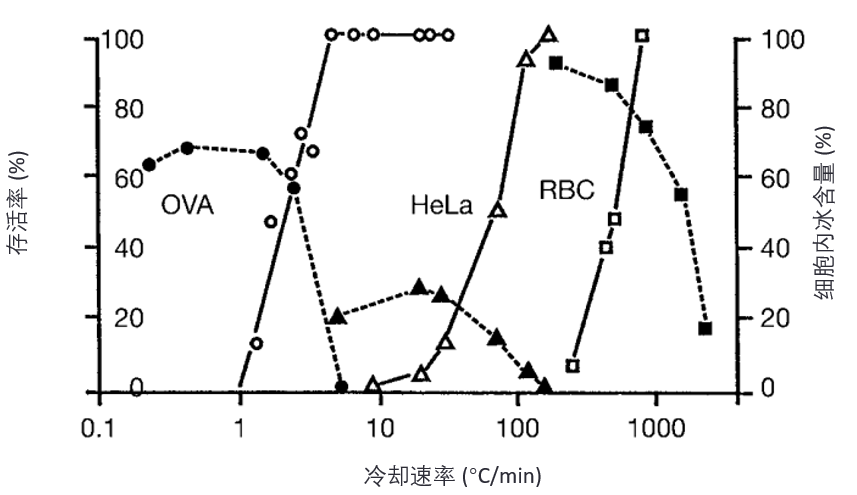
图8. 三种细胞的存活率随冷却速率的变化关系,并与所观察到的细胞内结冰(intracellular freezing)发生情况相关联。(经许可重印自文献 10)
实际上,极少量的胞内冰晶,仍可与细胞恢复相容,这也是复温速率(warming rate)对细胞存活具有重大影响的原因之一。
微小细胞内冰晶在缓慢与快速复温下的行为不同:缓慢复温允许冰晶再结晶、融合并生长,这已被证实会对细胞造成损害;而在快速复温过程中,由于时间不足,这些过程无法发生,冰晶仅简单融化。
由于降温速率影响细胞内冰的形成,而复温速率则决定这些冰晶后续的行为,而不同细胞在水通透性以及对细胞内冰晶的敏感性方面存在差异,因此,不同细胞在降温与复温的要求上也有所不同,降温速率与复温速率之间存在相互作用。
1.5 细胞堆积效应(Cell Packing Effect)
大多数关于冷冻损伤(freezing injury)的研究,都是在相对较稀的细胞悬液中进行。然而,在一些需要冷冻保存的系统中,细胞的排列却非常紧密,例如用于输血的红细胞(red blood cells),尤其是组织(tissues)和器官(organs)中的细胞。实验表明,在含有 2.5 M 甘油(glycerol)的溶液中悬浮的红细胞,在冷冻和解冻过程中发生溶血(hemolysis)的比例,在血细胞比容(hematocrit,即细胞体积百分比)超过 50% 时,与其具有显著相关性。
当甘油浓度提高时,随着血细胞比容增加所导致的溶血增加现象会有所缓解。在甘油浓度为 2 M 的条件下,当降温速率(cooling rate)低于 1000°C/min 时,溶血程度与复温速率(warming rate)呈负相关;而在更高的降温速率下,溶血则与降温速率呈正相关(11)。
这些现象无法用传统的冷冻损伤机制——溶液效应(solution effects)和细胞内结冰(intracellular freezing)来解释。最可能的解释是:在细胞密集排列的情况下,由于边界冰晶发生再结晶(recrystallization),导致其被隔离的通道发生形变,细胞更易受到机械应力(mechanical stresses)的损伤。
当细胞紧密堆积时,它们往往被限制在由冰晶形成的微小通道中。随着冰晶结构在冷冻或解冻过程中发生变化,这些通道的形状也可能发生改变,从而对细胞施加物理压力,导致细胞膜破裂或结构损伤。这种效应在稀疏细胞悬液中并不显著,但在高密度细胞系统(如浓缩红细胞制品或组织)中尤为突出。
这一发现强调了在冷冻保存高密度细胞系统或组织时,不仅要关注细胞本身的生理状态和冷冻保护剂的作用,还必须考虑细胞空间排列(spatial arrangement)和冰晶形态变化(ice morphology changes)所带来的机械损伤风险。这也为开发适用于组织和器官冷冻保存的策略提供了重要的理论依据。
2. 冷冻保护(Cryoprotection)
2.1 一般考虑(General Considerations)
冷冻保护(Cryoprotection)通常涉及使用冷冻保护剂(cryoprotectant)以高浓度处理细胞或组织。这种处理会通过渗透作用(osmosis)驱动水的移动,并通过扩散作用(diffusion)驱动溶质的移动。
冷冻过程(Freezing)会引起水溶液浓度和成分的变化,这同样会形成驱动力,促使水和溶质发生移动。生物系统中存在许多阻碍溶质自由扩散的屏障(如细胞膜),这些屏障可能导致隔室体积的瞬时变化,有时甚至是平衡状态下的变化;如果变化过于剧烈,就可能对细胞造成损伤。
因此,扩散(diffusion)和渗透(osmosis)过程在冷冻保存(cryopreservation)中非常重要。质量传递过程的定量描述已有较为成熟的研究(13,14)。
水流的驱动力是压力(pressure)。
因此,通过膜的水流量 Jv 可表示为:
Jv=k⋅P
其中,k 是与膜和水组合相关的常数,P 是膜两侧的压力差。下标 v 表示体积通量(volumetric flux)。
当膜中水流动的驱动力是渗透压(osmotic pressure)而非静水压(hydrostatic pressure)时,只要将渗透压 π 代替静水压代入上述公式,即可描述这种流动:
Jv=k⋅π
只要膜和溶剂(此处为水)保持不变,则这两个公式中的 k 值相同。因此,静水压差和渗透压差可以统一到一个公式中。此时,常数 k 被称为水力传导率(hydraulic conductivity),记作 Lp(单位:cm/(atm·s)):
Jv=Lp⋅(P+π)
在低温生物学(cryobiology)条件下,静水压项通常为零,而渗透压 π 可以通过浓度乘以通用气体常数(universal gas constant)R 与绝对温度(absolute temperature)T 的乘积来计算。
如果膜的面积为 A,细胞内外的渗透浓度(osmolality)分别表示为 Ci 和Ce,则有:
Jv=Lp⋅A⋅R⋅T⋅(Ci−Ce)
溶质通量 Js 可表示为:
Js=ωs⋅A⋅R⋅T⋅(Se−Si)
该公式表明,单位膜面积上的通量与溶质的渗透性(permeability)ωs 以及膜两侧的溶质浓度差成正比。更常见的溶质渗透系数 Ps(单位:cm/s)等于ωsRT。
常数 RT 的值为 23,235 atm·cm³/mol。
关于通量方向的约定是:由外向内为正(outside → inside is positive)。
1958 年,Kedem 和 Katchalsky(13)提出了一个更为复杂的数学模型,通常被称为 K–K 方程(Kedem–Katchalsky equations),在低温生物学中经常被引用。
Kedem 和 Katchalsky 假设溶剂和溶质共用膜中的一个通道,因此在方程中加入了一个溶剂/溶质相互作用项,称为反射系数(reflection coefficient),记作σ。由此对 Jv 和 Js 的方程进行了修正:
Jv=Lp⋅A⋅R⋅T⋅[(Ci−Ce)+σ(Cip−Cep)]
Js=ωs⋅A⋅R⋅T⋅[(Se−Si)+Jv(1−σ)cs]
在 Jv 的方程中,溶质被分为不可渗透溶质(impermeant solutes,记作 C)和可渗透溶质(permeating solutes,记作 Cp),后者在共用通道中与水相互作用。
在 Js 的方程中,新增了一项,表示溶剂拖曳作用(solvent drag)对膜中浓度为 cs 的可渗透溶质的影响。
显然,K–K 模型更为复杂,参数拟合可能会导致结果不确定性,因为参数 σ 之间缺乏独立性。
Kleinhans(14)详细讨论了这些问题,并指出由于水和溶质在膜中可能通过不同的通道传输,因此 K–K 模型在许多情况下并不适用。
在实际应用中,对于低温生物学家当前的需求而言,简化模型已经足够。这两个方程可以通过数值方法(numerical methods)同时求解,相关计算程序可以在普通 PC 上运行。
在低温生物学中,测定渗透参数(permeability parameters)的方法有多种:
• 如果研究的溶质可以进行放射性标记(radiolabeled),则可以通过测量同位素摄取的时间过程(time-course of isotope uptake)来确定渗透性,但需要额外测量每个时间点的含水量(water content)以计算浓度;
• 对于可渗透溶质,可以在已知暴露时间后提取,并使用高效液相色谱法(high-performance liquid chromatography, HPLC)进行定量分析;
• 使用卡尔·费歇尔法(Karl Fischer method)结合反滴定方案,是一种测定水含量的便捷方法(15);
• 如果研究的化合物具有独特的核磁共振谱(nuclear magnetic resonance spectrum),则可以通过核磁共振技术(NMR)同时测定溶质和水含量的时间过程,从而直接获得浓度信息;
• 一种常用的间接方法是:通过库尔特计数器(Coulter counter)或光散射法(light-scattering methods)记录细胞暴露于已知浓度化合物后体积变化的时间过程,然后利用上述方程对实验数据建模,从而估算出 Lp 和 Ps 的值。
接下来我们将更详细地讨论一些与冷冻保存相关的情境,其中这些渗透参数(permeability parameters)具有重要意义。
2.2 冷冻保护剂的引入(Introduction of Cryoprotectants)
细胞暴露于高浓度冷冻保护剂(cryoprotectant)中,会引起渗透性脱水(osmotic dehydration)。如果该冷冻保护剂具有可渗透性(permeability),则水会随着保护剂一起进入细胞,导致细胞体积增大,直到达到最终体积。
细胞体积的收缩程度以及体积变化速率由渗透参数(permeability parameters)决定。最终的平衡体积(equilibrium volume)取决于,溶液中不可渗透溶质(impermeant solutes)的浓度。只有当这些不可渗透溶质的摩尔浓度(per liter)为等渗浓度(isotonic)时,平衡体积才等于细胞正常体积。
这是因为冷冻保护剂在细胞内占据空间,因此如果细胞总体积要保持正常,则细胞内的水体积必须低于生理水含量(16)。体积变化的速率,特别是最终的平衡体积,在冷冻保存过程中都非常重要,必须在保存方案中进行优化。
2.3 冷冻保护剂的去除(Removal of Cryoprotectants)
细胞暴露于,较低浓度的冷冻保护剂中,以去除该物质时,由于渗透作用(osmotic uptake),水会进入细胞,导致细胞体积膨胀,超过其初始体积。
随后,随着冷冻保护剂从细胞中排出,伴随足够的水一起流出,细胞体积又会缩小,以维持渗透平衡(osmotic equilibrium)。只有在整个过程中不可渗透溶质既没有流失也没有增加时,细胞才能恢复到其正常的生理体积。
由于细胞通常对膨胀(swelling)比对收缩(shrinkage)更敏感,因此冷冻保护剂的去除过程往往比其添加过程更具风险性。
同样地,在设计冷冻保存细胞的复苏方案时,必须同时考虑体积变化速率和最终体积两个因素。
2.4 冷冻与解冻(Freezing and Thawing)
冷冻过程会使细胞周围的溶液浓缩,从而导致细胞以一定速率失水收缩(shrink)。该速率取决于冰晶形成速率、细胞的水力传导率(hydraulic conductivity, Lp)、其温度系数以及温度本身。
这一现象是细胞内结冰(intracellular freezing)发生与否的重要决定因素。最终的收缩程度则取决于冷冻保护剂的浓度。
2.5 暴露于不可渗透溶质中(Exposure to Nonpermeating Solutes)
将细胞浸入不可渗透溶质(nonpermeating solute)溶液中后,细胞会达到一个平衡体积(equilibrium volume),该体积与溶液的渗透浓度(osmolality)呈反比关系。
理想情况下,其关系可表示为:
Vrel=1/Mrel
其中:
• Vrel:细胞内水体积相对于生理水含量的比值;
• Mrel:外部溶液渗透浓度相对于生理值的比值。
这一关系意味着,如果将 Vrel 对 Mrel 作图(称为 Boyle van’t Hoff 图),应得到一条斜率为 1、且过原点的直线。因为在无限渗透浓度下,水含量为零(17)。
然而在实际中,图线通常在纵轴(y-axis)上存在一个截距,即所谓的非渗透水体积(nonosmotic water volume),记作 Vinf。
这可能代表细胞内一个物理上独立的水部分,结构非常有序,不参与溶液现象。
(另一种解释是:细胞内溶质的非理想行为,使得渗透浓度随浓度升高而增加得比线性关系更快。)
通过 Boyle van’t Hoff 图 所确定的 Vinf 值对于解释细胞的体积-时间数据(volume/time data)以及计算可渗透溶质的细胞内浓度至关重要。
在实验中,收集此类数据时,通常可结合测定细胞在无损伤条件下所能承受的最大和最小体积极限,以获得更有价值的信息。
3. 细胞与组织的保存(Preservation of Cells and Tissues)
3.1 细胞的保存(Preservation of Cells)
本文所回顾的基本低温生物学(cryobiological)知识,使人们能够开发出广泛细胞类型的有效保存方法,这些方法已在生物学和医学领域得到广泛应用。
例如,许多物种(包括牛、实验动物和人类)的精子(spermatozoa)、早期胚胎(embryos)与卵子(ova)、红细胞(red blood cells)与白细胞(white blood cells)、造血干细胞(hemopoietic stem cells)、组织培养细胞(tissue culture cells)等都可以通过冷冻保存实现长期储存(参见本卷后续章节)。
对于每一种细胞类型,都存在一组最佳保存条件(optimal preservation conditions),这些条件由该细胞的特定属性与前述低温生物学因素(cryobiological factors)之间的相互作用所决定。
如果细胞的特性已知,通常可以较为精确地预测(predict with reasonable precision)出能够实现有效冷冻保存的条件。
3.2 多细胞系统的保存(Preservation of Multicellular Systems)
当我们从单细胞系统(single-cell systems)过渡到复杂的多细胞系统(complex multicellular systems)时,保存的难度显著增加。
当然,细胞存活(cell survival)仍然是必须的,但组织和器官中包含多种不同类型的细胞,这些细胞在保存过程中可能具有截然不同的最佳保存需求(optimum requirements),这与单细胞保存中通常面对的单一细胞类型的情况完全不同。
因此,必须找到一种方法,使所有对组织功能至关重要的细胞都能获得足够的存活率(adequate survival)。
幸运的是,使用高浓度冷冻保护剂(high concentrations of cryoprotectant)可以降低(flatten)原本呈钟形的存活曲线,并拓宽其峰值范围(broadening of its peak):在足够高的冷冻保护剂浓度下,许多不同类型细胞的存活曲线可以重叠,从而实现较为统一的保存条件。
另一个问题是,仅获得组织和器官中各种细胞类型的高存活率是不够的(not sufficient);还必须避免对重要的细胞外结构(extracellular structures)造成损伤,并保持细胞之间的正常连接(normal interconnections)以及它们与基底膜(basement membranes)的附着关系(18)。
当冷冻细胞悬液时,细胞外形成的冰晶位于待保存系统的外部(outside the system),只能通过间接方式(如溶液效应)或对细胞施加剪切力或压缩力(shear or compressive force)间接造成损伤。
但在有序组织(organized tissues)中情况则完全不同:细胞外冰晶仍位于待保存系统内部,可以直接破坏组织结构(directly disrupt the structure)。
这种效应的最早证据(first evidence)是由 Taylor 和 Pegg(17)提供的。他们发现,平滑肌在含有 2.56 M 二甲基亚砜(dimethyl sulfoxide)的溶液中以 2°C/min 的速率冷却至 –21°C 后,其功能受到损伤;而在相同温度下仅暴露于该温度下冷冻所形成的溶液条件中,则无损伤发生。
通过冷冻替代法(freeze substitution)进行的结构研究表明,冰晶是在肌束内部(within the muscle bundles)形成的。
当冷却速率降低至 0.3°C/min 时,冷冻造成的损伤减少,且冰晶仅在肌束之间(between the muscle bundles)形成。
这表明细胞外冰晶(extracellular ice)会对组织造成损伤,而这种损伤的程度取决于冰晶形成的部位(site of formation)。
细胞外冰晶对组织的破坏作用也已在肾脏(kidneys)和肝脏(livers)中得到证实,其中冰晶被发现会导致毛细血管破裂(rupture of the capillaries)。
Rubinsky 和 Pegg(12)提出了这种效应的可能机制(proposed a mechanism):冰晶在血管腔内形成,从周围组织中吸取水分,直到腔内冰晶体积超过血管的弹性容量,从而导致血管破裂。
对于功能依赖于完整血管系统(intact vasculature)的器官和组织而言,即使许多细胞存活下来,血管破裂(vascular rupture)也是致命的,这一机制构成了此类系统有效冷冻保存的主要障碍(major barrier)。
避免结冰,或至少将冰晶限制在最少且最不敏感的位置(least susceptible locations),似乎是避免这一问题的唯一方法。
试图通过简单套用单细胞系统的冷冻保存技术(adapting techniques from single-cell systems)来保存复杂多细胞系统,通常收效甚微。
在医学领域,某些无需再血管化(revascularization)即可移植的组织可能情况更为有利,但这也取决于外科接受标准(surgical acceptability)的具体要求。
例如,心脏瓣膜移植物(heart valve grafts)的主要要求是胶原结构保持完整(collagen structure is intact),而供体成纤维细胞的存活是否具有实际作用仍不清楚。
同样,人类皮肤(human skin)可以通过与细胞悬液相似的方法进行冷冻保存,并保留大量具有活性的角质形成细胞(viable keratinocytes),尽管当皮肤移植物被用作严重烧伤患者的临时覆盖物时,这些细胞是否对临床结果产生影响仍存在疑问。
而对于其他组织,如小弹性动脉(small elastic arteries),直到最近才开发出较为满意的保存方法(21)。
至于角膜(corneas)、软骨(cartilage)以及完整血管化器官(whole vascularized organs),目前尚无有效的冷冻保存方法(no effective methods)。
3.3 玻璃化方法(Vitrification Methods)
在低温生物学发展的早期,Luyet(22)等人的研究大多基于一个假设:即结冰会直接损伤细胞(freezing damaged cells directly),因此,有效的保存方法必须完全阻止冰晶的形成(completely prevent crystallization of ice)。
Luyet 投入了大量精力寻找能够在生物系统中实现玻璃态(vitreous or glassy state)的条件,并且使活细胞能够存活。玻璃化(vitrification)是指溶液粘度(viscosity)达到足够高的值(约 ~10¹³ 泊,poises),从而表现出固体行为(solid-like behavior),但不发生结晶(without crystallization)。
在传统冷冻保存(conventional cryopreservation)过程中,随着冰晶逐渐形成,残留液体中的溶质浓度不断升高。最终许多系统会达到一个温度(Tg),此时残留液体在冰晶存在的情况下发生玻璃化(vitrifies in the presence of ice)(见图9)。
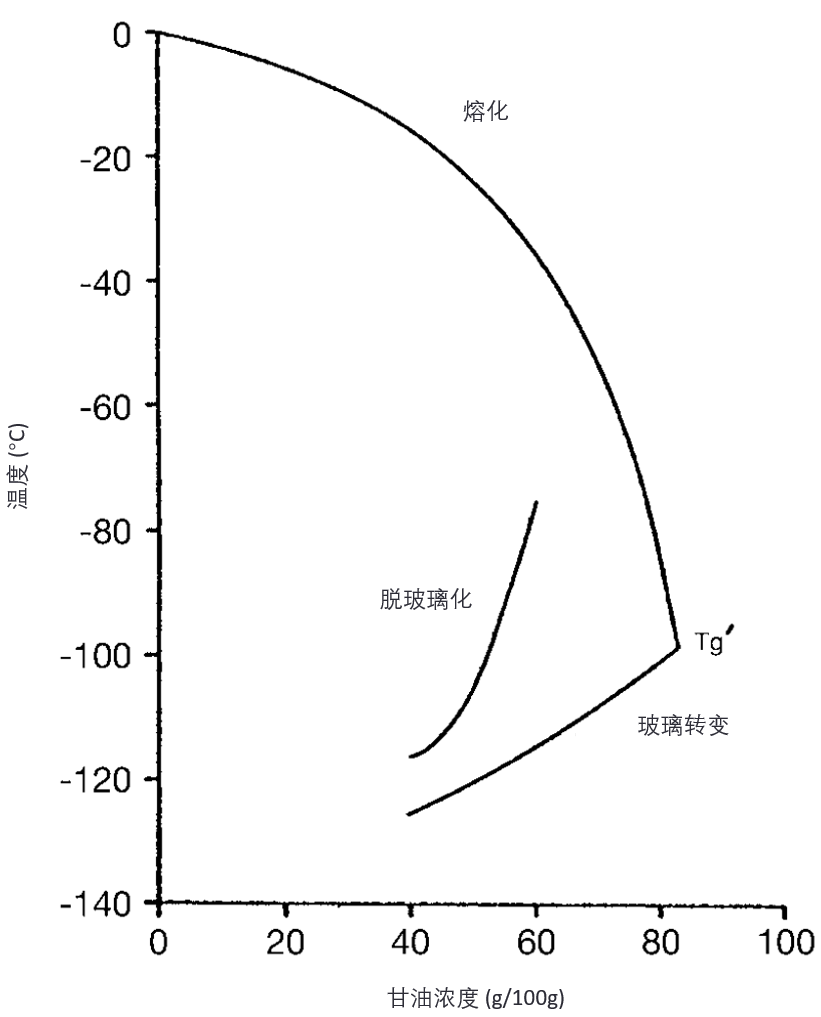
图9:甘油/水体系的补充相图。熔融曲线与玻璃化转变曲线在 Tg´ 处的交点,表示理论上能够发生玻璃化的最低甘油浓度。实际上,由于高粘度会抑制冰晶的形成,因此在熔融曲线上较低的温度通常难以达到。
细胞在这种情况下是可以存活的,这在传统冷冻保存中已有实现,但如果在0°C以上温度暴露于实现玻璃化所需的高浓度(~80% w/w)溶液中,细胞则无法耐受。
一些其他溶质可以在较低浓度下实现玻璃化,例如丁二醇(butane-2,3-diol)在约 35%(w/w)即可玻璃化,但不幸的是,这种化合物比甘油(glycerol)更具毒性。
Luyet 已经认识到,如果使用足够快的冷却速率(sufficiently rapid cooling),就可以实现比上述更低浓度溶液的玻璃化。其原因是:冰晶是通过水分子在晶核(nucleus)上不断聚集而形成的。
晶核形成(nucleation)和冰晶生长(ice crystal growth)这两个过程都与温度有关。
在平衡冻结点(equilibrium freezing point)以下,晶核形成的可能性较低(这就是过冷现象supercooling),但随着温度继续下降,晶核形成的可能性逐渐增加,达到一个最大速率后,又因水分子运动受粘度限制而下降。
而冰晶生长则在刚低于冻结点时最强,随后随着冷却而逐渐减缓,最终停止。
这两个过程的相互作用使冷却样品可能出现三种情况(见图10):
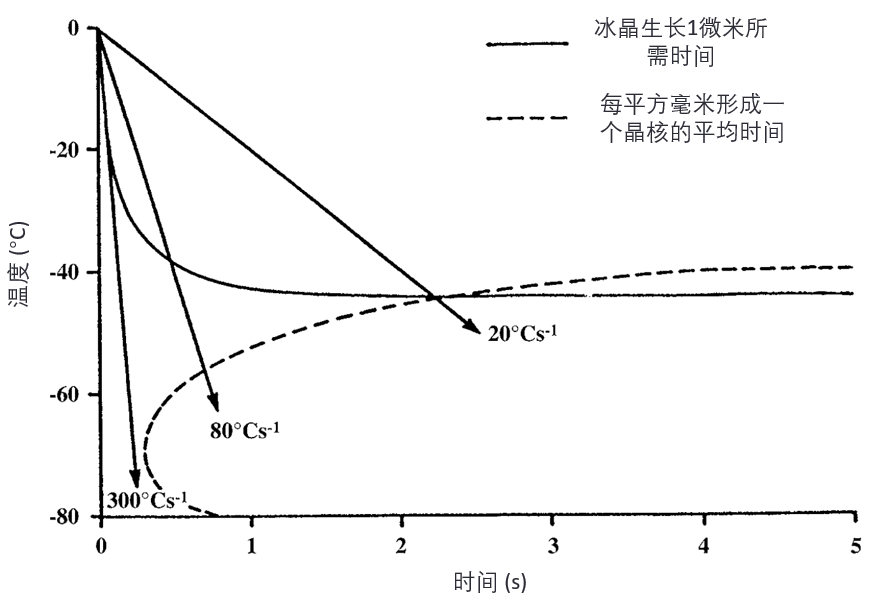
图10:根据 Luyet 的数据绘制的图示,显示在一层 50%(w/v)聚乙烯吡咯烷酮(polyvinylpyrrolidone)溶液薄膜中,晶核形成与冰晶生长的时间-温度依赖关系。箭头表示不同冷却速率下的冷却路径:避免晶核形成的冷却速率(300°C/s)、形成晶核但不发生晶体生长的冷却速率(80°C/s)、以及形成冰晶的冷却速率(20°C/s)。
• 冷却速率很快时,可以避开晶核形成和冰晶生长;
• 冷却速率足够慢时,样品会形成晶核并冻结;
• 中等冷却速率下,可能形成晶核但不发生冰晶生长。
而在复温(warming)过程中,只有两种可能:
• 如果复温速率足够快,样品可以在复温过程中避开晶核形成和冰晶生长;
• 否则,其热力学路径将穿过晶核形成和冰晶生长两个区域,从而在未晶核化时发生晶核形成,随后冰晶生长,最终才融化。
因此,除非使用足够高浓度的冷冻保护剂(cryoprotectant)以确保在任何情况下都不发生冰晶形成,否则在复温过程中仍存在结冰风险。
问题在于,大块组织和器官在实际中无法以超过每分钟几度的速度冷却。而对于小样本(small samples),快速冷却是可行的,例如成功实现果蝇胚胎(Drosophila melanogaster embryos)的玻璃化(24)。
这些胚胎是由约 50,000 个高度分化的细胞组成的复杂生物体,传统的冷冻方法无法保存它们。
成功的方法包括:仔细渗透蜡质卵黄膜(permeablization of the waxy vitelline membrane),以便冷冻保护剂进入;
• 暴露于 8.5 M 乙二醇(ethanediol);
• 以 100,000°C/min 的速率冷却;
• 在约 –200°C 下保存;
• 再以 100,000°C/min 的速率复温。
其中,极高的复温速率(extremely high rate of warming)比冷却速率更为关键,这与维持玻璃态的必要性是一致的。
近年来,由于发现组织中冰晶形成会造成严重损伤,人们对使用高浓度冷冻保护剂实现完全玻璃化的兴趣重新被激发。
当前的研究重点是寻找能在复温过程中抑制冰晶形成(inhibit ice crystal formation during warming)的材料(25,26)。一个有前景的方向是利用一些极地鱼类和越冬昆虫在自然进化中发展出的抗冻蛋白(antifreeze proteins)。
这类化合物的一个作用是降低防止冰晶结晶所需的复温速率(reduce the warming rate required to prevent ice crystallization),使之更易于实现。
这种方法目前正与电磁加热(electromagnetic heating)技术结合使用(27,28),以实现更快且更均匀的加热(more rapid and more uniform heating)。
尽管在设计低毒性的玻璃化混合液(vitrification cocktails)方面已取得进展,但冷冻保护剂毒性(cryoprotectant toxicity)仍是主要问题。
解决这一问题的一种方法是:在冷却过程中逐步增加冷冻保护剂浓度,使组织中的浓度沿液相线(liquidus curve)变化:这样既不会形成冰晶,又不会使细胞暴露于比冷冻过程中更高的冷冻保护剂浓度。
这种方法最近已被证明对关节软骨(articular cartilage)的冷冻保存非常实用且有效,而关节软骨是一种原本难以保存的组织(otherwise recalcitrant tissue)(29)。
同样的方法可能适用于其他耐冻组织,甚至可能扩展到器官保存。
参考文献
微生物保藏中心技术基石:冷冻保存与真空冻干操作规程. https://www.huizaobio.com/article/a343.html # 参见第一章末尾
敬请关注“灰藻生物”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-07-28
编制人:小灰 | 审稿人:小藻
