《乳酸菌冻干工艺:工艺流程、保护机制、冻干设备等》
来源:武汉市灰藻生物科技有限公司 浏览量:282 发布时间:2025-08-18 22:15:22
引言
冻干已成为保存乳酸菌的标准工艺。要开发稳定的冻干乳酸菌(lactic acid bacteria,LAB),关键在于:
保持细胞的生物活性、维持冻干产物的宏观多孔结构,同时提高生产工艺的效率。
保护剂的物理特性,特别是玻璃化转变温度 (Tg) 和塌陷温度 (Tc),不仅是工艺优化的核心要素,也直接关系到冻干乳酸菌的长期稳定性。
本章介绍了一种逐步方法,用于开发适合乳酸菌长期保存的保护剂配方,以及高效的冷冻干燥工艺。还描述了测定保护剂溶液,和细胞悬浮液的玻璃化转变温度、塌陷温度,以及冻干产品的水活度和含水量的方法。
# 关键词: 玻璃化转变温度 (Tg),塌陷温度 (Tc),乳酸菌 (LAB),冻干保护剂 (Lyoprotectants),冷冻干燥 (Freeze-drying/Lyophilization),配方 (Formulation),稳定剂 (Stabilizers)
1、介绍
乳酸菌(Lactic Acid Bacteria,LAB)很早就被用于保存农产品原料。如今,LAB在食品、保健品(益生菌)和生物技术产业中至关重要。浓缩即用型菌种(发酵剂)市场持续增长,预计未来5年益生菌市场将以每年7%的速度增长,到2023年达到690亿美元。
冷冻干燥是保障生物活性产品长期稳定的核心方法。它通过升华作用(冰→水蒸气),在远低于0℃(通常-40℃至-20℃)下移除水分。但此过程中,细菌会面临多重胁迫(热、渗透压、机械、氧化),导致细胞损伤、活性丧失及功能下降(产酸、风味物质生成、益生功能等)(见图1)。
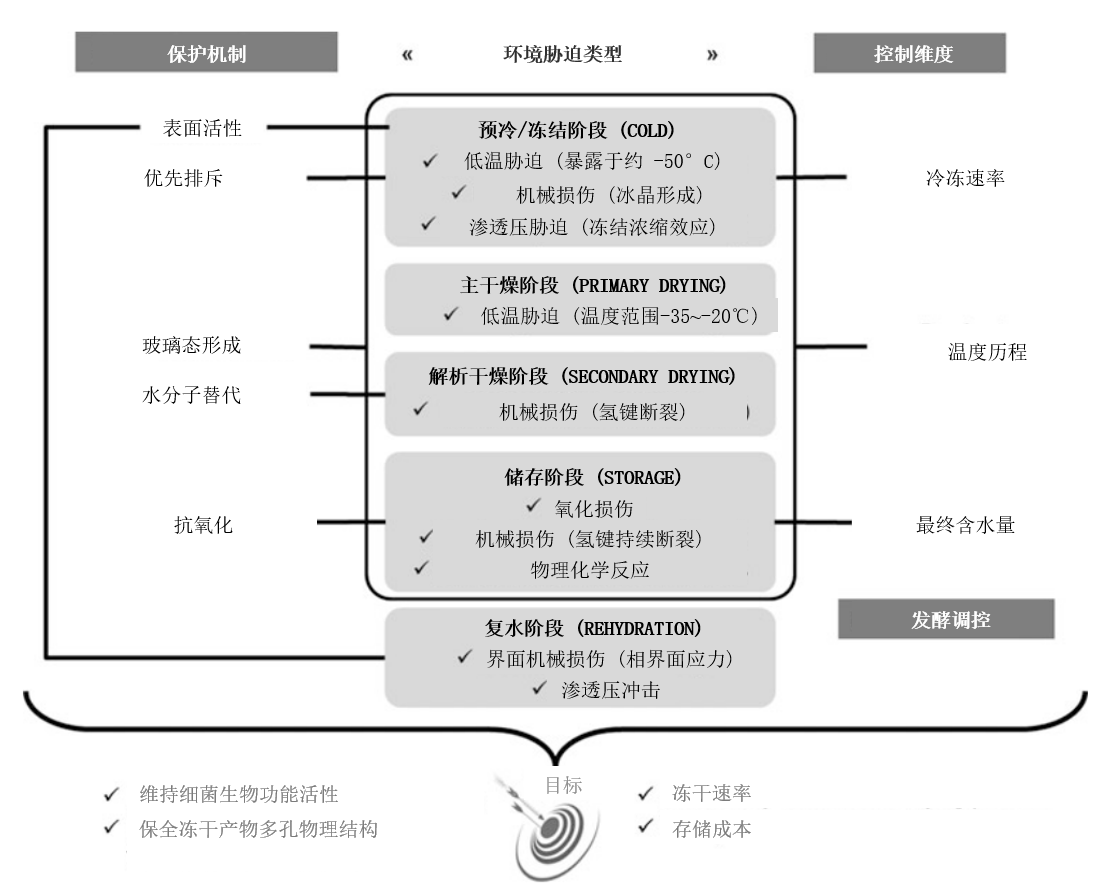
图1、乳酸菌冷冻干燥各阶段胁迫类型及防护策略总览
三大保护策略:
(1)添加保护剂:冻干前加入保护分子;
(2)优化工艺参数:控制冷冻速率、冻干温度、最终含水量及储存条件;
(3)细菌适应性改造:通过调整发酵条件改变LAB膜特性,提升抗逆性。
# 注:适应性改造耗时且菌株依赖性高,无法替代配方与冻干工艺优化。
冻干工艺设计的核心:
• 主干燥阶段(冰升华)是耗时最长的环节,需在最高允许温度(Tmax)下进行,以提升效率。
• 若温度超过Tmax,物料会发生塌陷:多孔结构破坏,导致复溶性差、含水量高、功能丧失。
• 关键温度参数:
| 温度类型 | 定义与意义 |
|---|---|
| Tg' | 最大冻结浓缩相的玻璃化转变温度(通过DSC测定) |
| Tcoll | 塌陷温度(通过冻干显微镜FDM观测) |
• 重要发现:LAB细胞的存在使冻干物耐热性提升,塌陷温度可比纯保护剂溶液高约10℃!
保护剂配方的关键作用:
保护剂成分直接影响Tg'、Tcoll和Tg,是优化产品质量与工艺的核心。
• 选择原则:优先采用能提升Tmax的保护分子,减少降低Tmax的成分(见表2)。
• 保护剂功能:抵御冷冻/干燥损伤,维持生物活性(常见分子及机制见表1)。
表1、乳酸菌长期保存(冷冻/冻干/干燥)关键保护分子及其作用机制
| 保护机制 (Protective mechanism) | 定义 | 类别 (Group) | 代表物质 (Example) |
|---|---|---|---|
| 优先排斥 (Preferential exclusion) | 保护分子在细胞表面形成水合层,阻隔冰晶直接接触细胞膜 | 单糖 双糖 糖类 多元醇 多糖 氨基酸 | 葡萄糖、果糖、半乳糖 蔗糖、麦芽糖、乳糖、海藻糖 棉子糖、五异麦芽糖、麦芽三糖 甘油、山梨醇、甘露醇、肌醇、木糖醇 麦芽糊精、菊粉、果寡糖(FOS)、半乳寡糖(GOS) 甘氨酸、谷氨酸钠、甜菜碱 |
| 水分子替代 (Water substitution) | 干燥过程中通过氢键替代水分子,维持蛋白质/膜脂结构 | 双糖 糖类 多元醇 | 蔗糖、麦芽糖、乳糖、海藻糖 棉子糖、葡萄糖、果糖、半乳糖 甘露醇、山梨醇、肌醇 |
| 玻璃态形成 (Glassy state) | 形成无定形玻璃体,抑制分子运动(核心温度参数:Tg) | 单糖 双糖 糖类 多元醇 多糖 | 葡萄糖、果糖、半乳糖 蔗糖、麦芽糖、乳糖、海藻糖 棉子糖、五异麦芽糖、麦芽三糖 甘油、山梨醇、甘露醇、肌醇、木糖醇 麦芽糊精、菊粉、果寡糖(FOS)、半乳寡糖(GOS) |
| 抗氧化 (Antioxidant) | 清除活性氧自由基,保护膜脂和DNA | - | 维生素C(抗坏血酸)、抗坏血酸钠、维生素E、没食子酸丙酯 |
| 表面活性 (Surfactant) | 降低溶液表面张力,减少冰晶机械损伤 | - | 吐温80 |
注:
1. FOS = 果寡糖 (Fructooligosaccharides)
2. GOS = 半乳寡糖 (Galactooligosaccharides)
3. 加粗为乳酸菌冻存最常用保护剂
现代开发逻辑:
配方设计与冻干工艺开发需同步进行,基于物性表征(Tg'/Tcoll/水分活度/含水量)实现科学优化。本章将逐步阐述:
1. LAB保护配方的开发方法;
2. 高效冻干工艺的建立流程;
3. 关键物性参数的测定技术。
本节小结:
1. 乳酸菌冻干的行业价值
• 应用领域:食品发酵、益生菌保健品、生物技术
• 市场增长:益生菌年增速7%,2023年达690亿美元
2. 冻干过程的挑战与应对策略
| 挑战来源 | 损伤后果 | 解决方案 |
|---|---|---|
| 低温脱水胁迫 | 细胞活性/功能丧失 | 三向保护策略: (热/渗透压/机械/氧化) (产酸/风味/益生功能下降) 1. 添加保护剂(见表1) 2. 优化工艺参数(温度/压力/水分控制) 3. 细菌适应性改造(调整发酵条件) |
注:适应性改造耗时且菌株依赖性强,无法替代配方与工艺优化。
3. 工艺核心:温度控制与塌陷预防
| 关键温度 | 符号 | 测定方法 | 实际意义 |
|---|---|---|---|
| 玻璃化转变温度 | Tg' | DSC(差示扫描量热) | 冻干物维持稳定的最高温度参考值 |
| 塌陷温度 | T coll | FDM(冻干显微镜) | 冻干过程中结构不塌陷的最高温度(LAB细胞可提升10℃!) |
| 最高允许温度 | Tmax | 由Tg'/Tcoll推算 | 主干燥阶段可设置的安全工艺温度(需低于Tcoll) |
工艺要点:
• 主干燥阶段需在 Tmax 下操作以提升效率;
• 温度超过 Tcoll 将导致结构塌陷→复溶性差、含水量高、功能丧失。
4. 保护剂开发的核心原则
• 目标:提升Tg'/Tcoll以扩大安全工艺窗口
• 策略:
o 优选提高Tmax的保护分子(如多糖、聚合物)
o 减少降低Tmax的成分(如低分子量糖类)
5. 现代冻干工艺开发逻辑
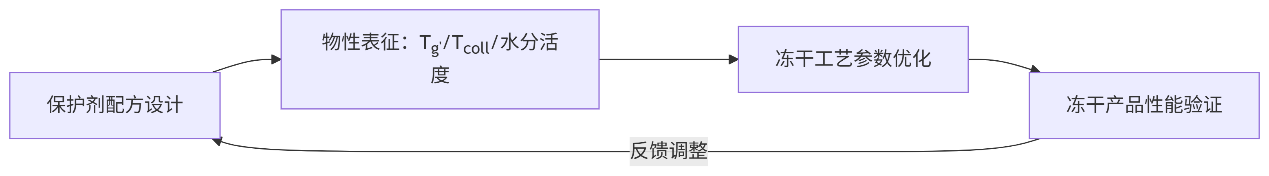
核心要求:配方与工艺需同步开发,基于物性数据实现科学决策!
2、材料
2.1 差示扫描量热仪 (Differential Scanning Calorimeter, DSC)
1. 设备 1
o 型号:功率补偿型 DSC Diamond(珀金埃尔默公司,美国康涅狄格州)
o 配件:液氮冷却装置(CryoFill)
o 温度校准物质:
| 物质 | 相变类型/温度 |
|---|---|
| 环己烷 | 晶-晶转变 @ -87.1°C |
| 汞 | 熔点 @ -38.6°C |
| 正十八烷 | 熔点 @ 27.8°C |
o 用途:液态样品分析
2. 设备 2
o 型号:功率补偿型 DSC Pyris 1(珀金埃尔默公司)
o 配件:机械冷却系统
o 温度校准物质:
| 物质 | 相变温度 |
|---|---|
| 环己烷 | 熔点 @ 6.5°C |
| 正十八烷 | 熔点 @ 27.8°C |
| 铟 | 熔点 @ 156°C |
o 用途:冻干样品分析
3. 耗材
o 50 μL 铝制样品皿及盖(珀金埃尔默)
o 样品皿密封压片机
2.2 冷冻干燥显微镜系统
1. 核心设备
o 显微镜:尼康 Eclipse E600 偏光显微镜(日本),配 10× 物镜
o 冷冻台:FDCS 196 冻干冷台(Linkam 公司,英国)
温控器:可编程 TMS94
冷却:液氮系统
真空泵:Edwards E2M1.5
真空计:皮拉尼规
2. 成像组件
o 相机:Retiga 2000R 单色数字相机(QImaging,加拿大)
3. 耗材
o 16 mm 石英盖玻片
o 13 mm 玻璃盖玻片
o 金属垫片
2.3 冷冻干燥机
1. 中试冻干机配置
o 温控层板:-50°C 至 50°C
o 压力控制:电容式压力计
o 过程监控传感器:
| 类型 | 功能 |
|---|---|
| 热电偶 | 实时样品温度监测 |
| 皮拉尼规/水分传感器 | 升华终点判定 |
2. 辅助系统
o 计算机与专用软件:设备控制、数据采集与分析
o 样品容器:冻干瓶、托盘、铝杯等
o 储存包装:铝箔袋 + 真空封口设备
2.4 细菌冻干保护剂配方
1. 菌体制备
o 来源:发酵浓缩后菌泥
2. 保护剂组分设计
| 组分类型 | 功能机制 | 代表物质 |
|---|---|---|
| (a) 稳定剂 | 替代水分子结合蛋白质/磷脂极性头基(如双糖) | 海藻糖、蔗糖 |
| (b) 高分子增稠剂 | 提升溶液玻璃化转变温度(Tg') | 麦芽糊精、葡聚糖 |
| (c) 抗氧化剂 | 抑制储存期氧化反应 | 抗坏血酸、维生素 E |
| (d) 辅助添加剂 | 特定需求(如表面活性剂降低冰晶损伤) | 吐温 80、氨基酸(甘氨酸) |
3. 关键参考:表 2 列出常用保护剂的物理参数(Tg' 与 Tcoll)
表2、乳酸菌长期冻存保护剂溶液关键物性参数(通过DSC测定Tg',FDM测定Tcoll)
| 保护剂成分 | 浓度 (% w/w) | Tg'2 (°C) | Tg'1 (°C) | Tcoll (°C) |
|---|---|---|---|---|
| 单糖 | ||||
| 果糖 (Fructose) | 20 | -57 | -44 | -43 |
| 葡萄糖 (Glucose) | 20 | -56 | -44 | -42 |
| 半乳糖 (Galactose) | 10 | -55 | -42 | -41 |
| 双糖 | ||||
| 蔗糖 (Sucrose) | 20 | -46 | -33 | -31 |
| 海藻糖 (Trehalose) | 20 | -40 | -29 | -26 |
| 乳糖 (Lactose) | 10 | -38 | -28 | -27 |
| 麦芽糖 (Maltose) | 20 | -40 | -29 | -27 |
| 寡糖 | ||||
| 棉子糖 (Raffinose) | 20 | -37 | -26 | -24 |
| 蔗果三糖 (Kestose) | 20 | -38 | -28 | -26 |
| 蔗果四糖 (Nystose) | 20 | -38 | -28 | -23 |
| 呋喃果糖基蔗果四糖 (Fructofuranosylnystose) | 20 | -35 | -23 | -21 |
| 五异麦芽糖 (Pentaisomaltose) | 20 | -30 | -19 | -18 |
| 多糖 | ||||
| 菊粉 (Inulin,菊苣来源) | 10 | -30 | -17 | -15 |
| 果寡糖 (FOS,菊苣来源) | 10 | -27 | -17 | -15 |
| 麦芽糊精 (Glucidex®) | ||||
| Glucidex 2 (DE2) | 20 | -4 | ND | - |
| Glucidex 6 (DE6) | 20 | -7 | -3 | - |
| Glucidex 12 (DE12) | 20 | -11 | -8 | - |
| Glucidex 19 (DE19) | 20 | -11 | -10 | - |
| 蔗糖/Glucidex 6 混合物 | ||||
| 25:75 (%) | 20 | -15 | -11 | - |
| 50:50 (%) | 20 | -32 | -23 | -17 |
| 75:25 (%) | 20 | -43 | -30 | -25 |
| 含菌体系 | ||||
| 生理盐水蔗糖溶液 | 20 | -50 | -34 | -32 |
| 菌泥/保护溶液 (1:2 g/g)* | - | -51 | -36 | -27 |
注释
(1)术语缩写:
o DSC:差示扫描量热法 (Differential Scanning Calorimetry)
o FDM:冷冻干燥显微镜 (Freeze-Drying Microscopy)
o Tg':最大冻结浓缩相玻璃化转变温度
o Tg'1:冻干过程安全温度上限(超过此温度可能引发塌陷)
o Tg'2:体系完全进入玻璃态的临界温度(决定储存稳定性)
o Tcoll:塌陷温度
o FOS:果寡糖 (Fructooligosaccharides)
o ND:未测定 (Not Determined)
(2)特殊说明:
o Glucidex®:不同DE值(葡萄糖当量)的麦芽糊精(法国Roquette公司提供)
o 菌泥/保护溶液*:
菌泥 (CP):Lactobacillus delbrueckii ssp. bulgaricus CFL1 乳清培养基培养物 [15]
保护溶液 (PS):生理盐水 + 20% (g/g) 蔗糖
(3)数据可靠性:
所有溶液用去离子水配制
三次重复实验测定,表中数据为中位数
温度误差范围:±1°C(四分位距)
2.5 冻干产品水活度与含水量测定
1. 操作环境
o 干燥空气持续吹扫的防潮操作舱
2. 水活度(aw)检测
o 设备:LabMaster-aw 水活度仪(Novasina,法国)
o 耗材:专用塑料样品杯
3. 含水量检测(卡尔费休法)
| 组件 | 型号/试剂 | 生产商 |
|---|---|---|
| 滴定仪 | Metrohm KF 756 | 瑞士万通 |
| 滴定试剂 | Hydranal® Coulomat AG | Honeywell Fluka(德国) |
| 无水甲醇 | Hydranal™ methanol dry | Honeywell Fluka |
| 进样针 | 1 mL Microliter™ syringe | Hamilton(瑞士) |
| 样品瓶 | 4 mL 玻璃瓶+密封垫/盖 | - |
| 研磨工具 | 研钵与杵 | - |
3 实验方法
开发流程:图2展示了基于物性参数(Tg'与Tcoll)设计乳酸菌冻干保护配方的逐步方法。
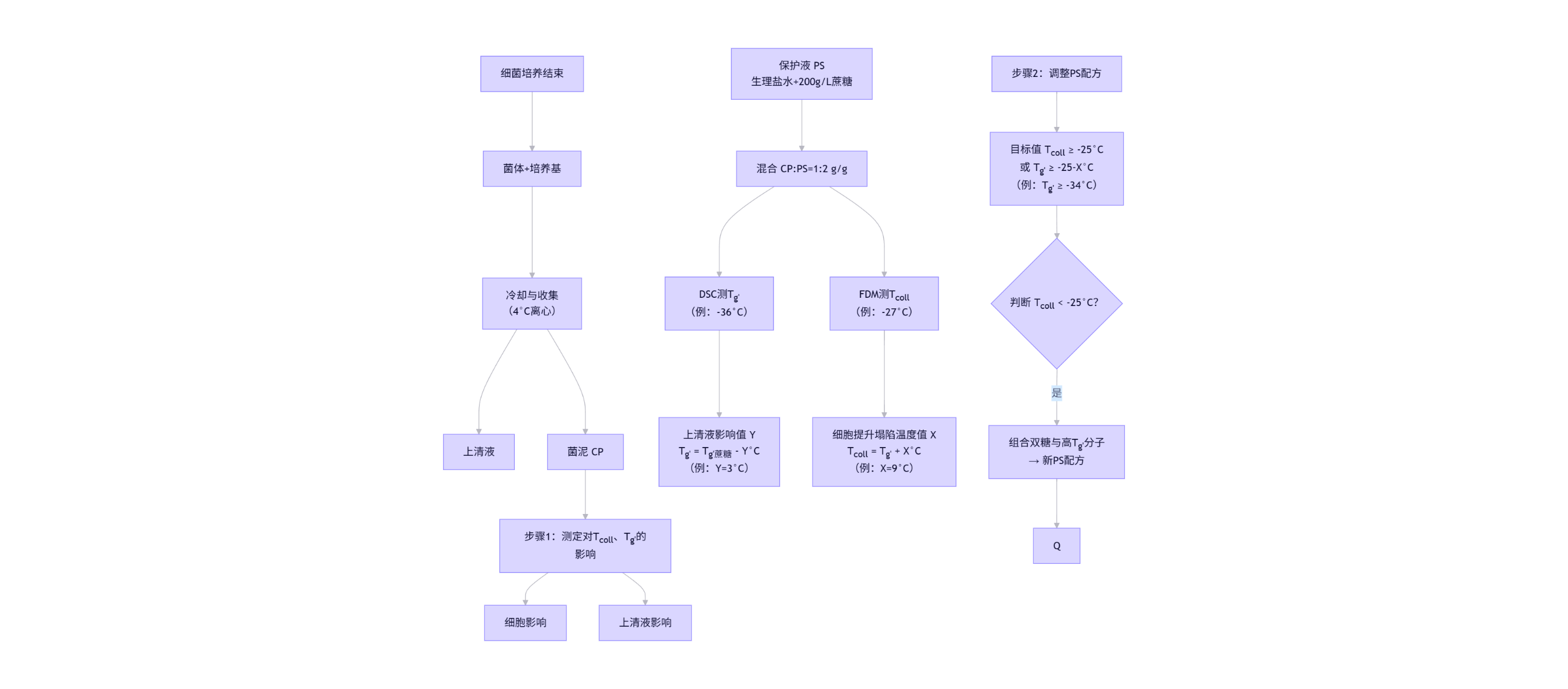
图2、乳酸菌冻干保护剂配方开发流程图
缩写说明:
• CP:菌泥 (Cell Pellet)
• PS:保护溶液 (Protective Solution)
• DSC:差示扫描量热法 (Differential Scanning Calorimetry)
• FDM:冷冻干燥显微镜 (Freeze-Drying Microscopy)
• Tg':最大冻结浓缩相玻璃化转变温度
• Tcoll:塌陷温度
3.1 细胞与上清液对物性参数(Tcoll/Tg')的影响测定
1. 菌体培养
o 按自有流程或文献方法培养细菌
2. 基础保护液(PS)配制
o 200 g/L 蔗糖 + 9 g/L NaCl
3. 菌泥(CP)制备
o 离心条件:17,000 ×g, 4°C, 30 min → 弃上清
4. 菌体-保护液混合
o CP:PS = 1:2(质量比)
o 充分涡旋重悬
5. Tg'测定(DSC法)
| 参数 | 设置 |
|---|---|
| 样品量 | 15 μL(密封铝皿) |
| 温度程序 | 降温:20→-100°C (10°C/min) → 恒温1 min → 升温:-100→20°C (10°C/min) |
| 数据分析 | 取升温段热流一阶导数峰值 → Tg'2(核心玻璃化转变温度) |
6. Tcoll测定(冻干显微镜法)
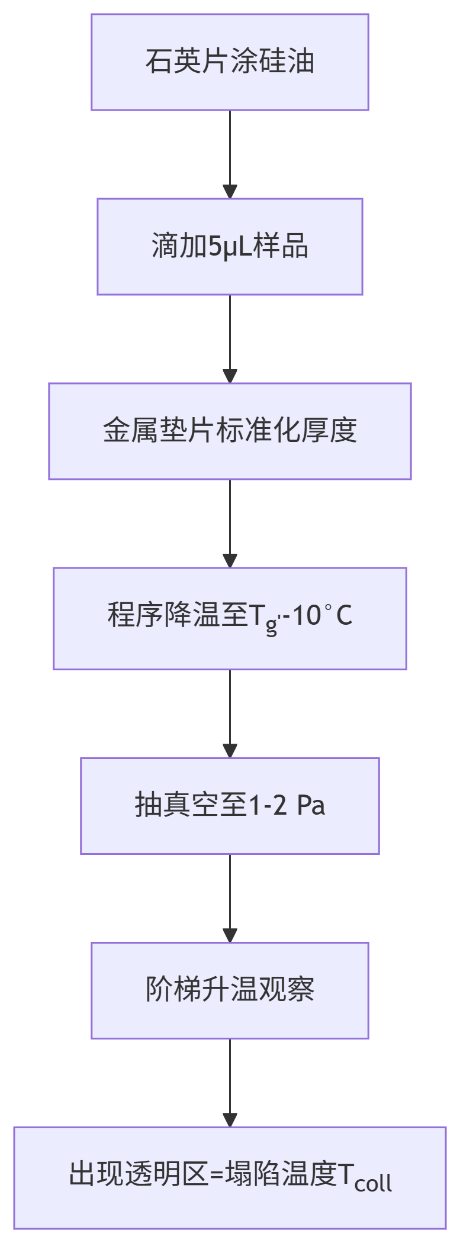
7. 关键参数计算
o 细胞提升塌陷温度值:X(°C) = Tcoll - Tg'
o 上清残留降低Tg'值:Y(°C) = Tg'(纯蔗糖) - Tg'(CP/PS)
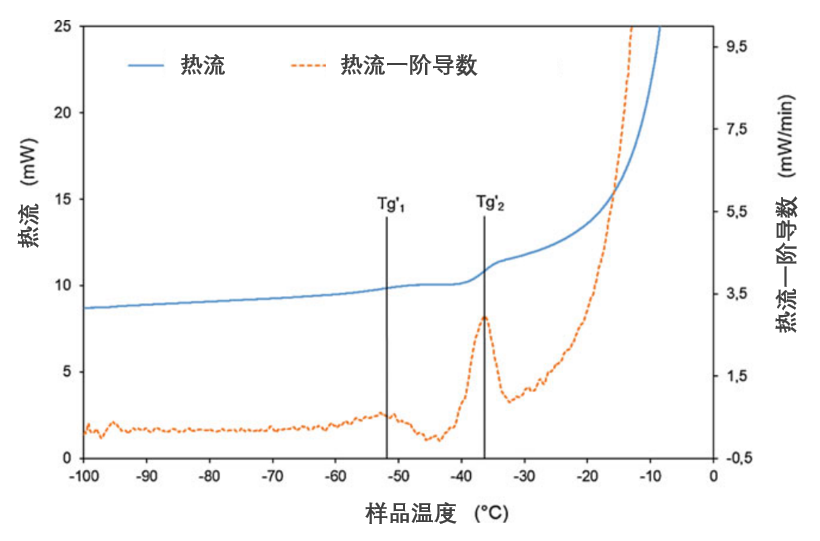
图3、含菌体-保护剂冷冻溶液的DSC升温扫描曲线
*(德氏乳杆菌保加利亚亚种CFL1菌泥(CP)与生理盐水+20%蔗糖保护液(PS)混合体系,CP/PS=1:2 g/g;升温速率10°C/min)*
关键参数:
Tg'1 与 Tg'2:玻璃化转变温度区间的中值点
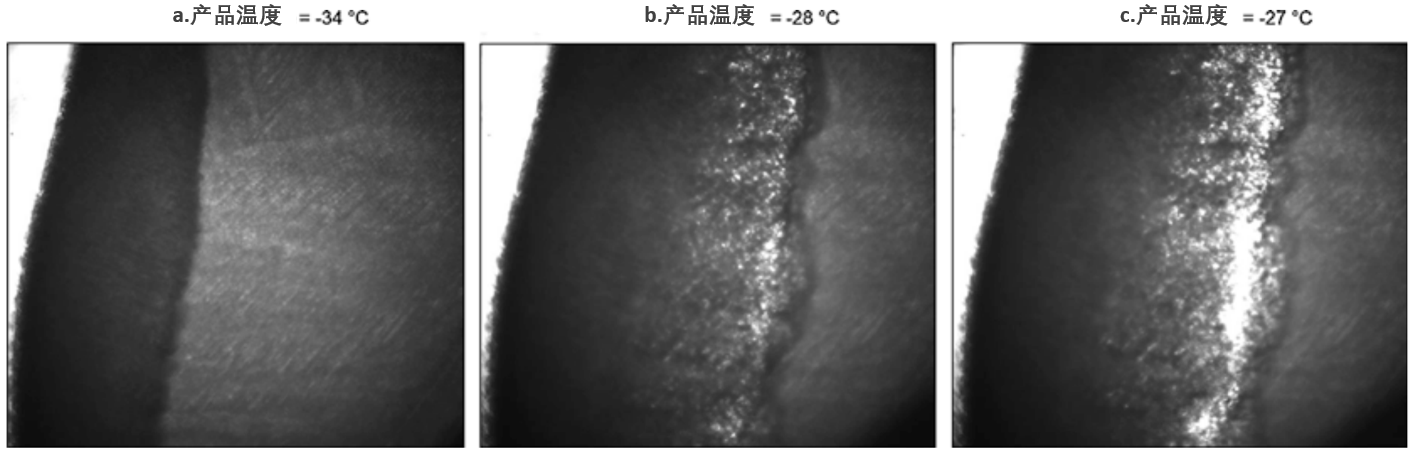
图4、含菌体-保护剂样品的冻干显微镜观察
*(德氏乳杆菌保加利亚亚种CFL1菌泥(CP)与生理盐水+20%蔗糖保护液(PS),CP/PS=1:2 g/g)*
| 子图 | 温度 | 现象描述 |
|---|---|---|
| a | -34°C | 干燥区结构完整 |
| b | -28°C | 干燥区出现塌陷起始点 |
| c | -27°C | 干燥区结构完全塌陷(整体失稳) |
3.2 保护液(PS)配方优化
| 判定条件 | 操作路径 |
|---|---|
| Tcoll > -25°C | 直接采用当前配方 |
| Tcoll < -25°C | 按以下流程优化: |
优化步骤:
1. 新配方设计
o 添加高Tg'/Tcoll分子(如多糖)
o 保持总浓度≈200 g/L
2. Tg'预筛(公式法)
Tg′M=∑(Tg′i×Ci)/∑Ci
注:Tg'i=组分i的Tg'值, C_i=其浓度
3. 配方筛选标准
o 要求:Tg' > [-25 - X + Y]°C
4. 复测验证
o 按CP:PS=1:2混合 → 冻干显微镜测Tcoll
o 达标(Tcoll > -25°C)则采用
5. 仍不达标时的选择
o 方案A:添加更高Tcoll分子
o 方案B:菌泥用生理盐水洗涤后再混合
3.3 冷冻干燥实验方案
1、准备阶段
(1)保护液配制
o 400 g/L 总溶质浓度(生理盐水基质)
o 120°C 灭菌20 min → 4°C 储存
(2)抗氧化剂溶液
o 抗坏血酸钠 10 g/L(生理盐水)
o 0.2 μm 滤膜除菌 → 避光保存(有效期≤1天)
(3)工作液混合
o 保护液:抗氧化剂 = 1:1(体积)
o 终浓度:保护分子200 g/L + NaCl 9 g/L + 抗坏血酸钠 5 g/L
o 避光操作,现配现用
2、菌体处理
(4)细菌培养
(5)无菌转移至离心瓶
(6)离心收集菌泥:17,000 ×g, 4°C, 30 min → 弃上清
3、冻干核心流程
| 步骤 | 参数 | 控制要点 |
|---|---|---|
| (7)菌体-保护液混合 | CP:PS=1:2 (g/g) | 冰浴涡旋充分重悬 |
| (8)分装 | 装填高度≈1 cm | 无菌操作 |
| (9)预冷装载 | 层板预冷至4°C | 避免温度波动 |
| (10)温度监测 | 容器底部埋热电偶 | 橡胶圈固定 |
| (11)预冻 | -50°C (降温速率0.5-1°C/min) | 维持2h至完全凝固 |
(12)主干燥
• 冷阱温度 < -65°C
• 真空度10 Pa
• 层板升温至-10°C (1°C/min) | 皮拉尼规监测升华终点
(13)升华终点判定,皮拉尼规读数=电容规读数,见图5
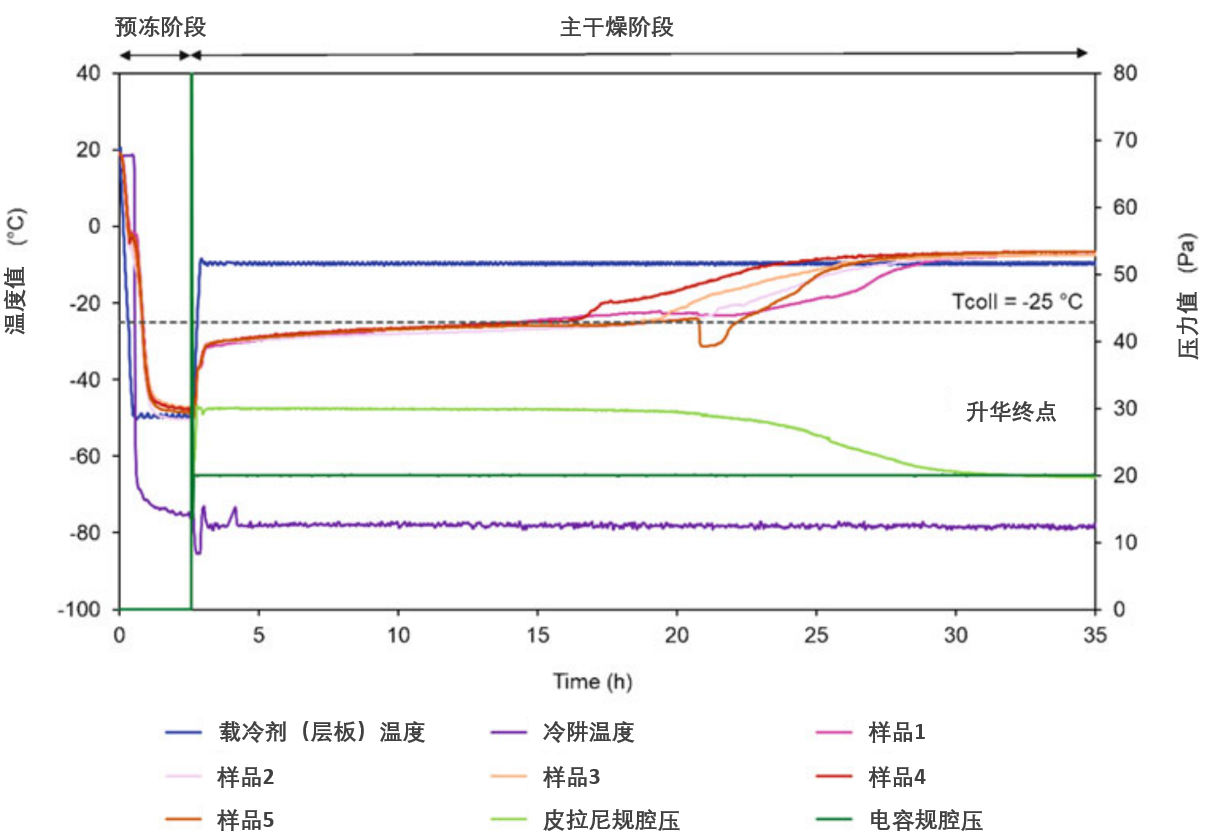
图5、冻干工艺参数时变曲线
(14)解析干燥
• 升温至25°C (0.25°C/min)
• 真空度降至最低 | 去除结合水 |
(15)后处理
• 干燥空气破真空
• 铝箔袋真空封装
• 储存温度:Tg-20°C 或暂存-20°C
3.4 冻干产品表征
样品前处理
1. 干操环境研磨冻干饼→粉末(注意:避免吸湿)
水活度(aw)检测
2. 操作流程:

玻璃化转变温度(Tg)检测
3. DSC程序:
| 步骤 | 温度程序 | 速率 |
|---|---|---|
| 1 | 20°C → -10°C | 10°C/min |
| 2 | -10°C恒温 | 1 min |
| 3 | -10°C → 150°C | 10°C/min |
o 数据分析:取升温段热流一阶导数峰值→Tg
o 消除热弛豫干扰:增加二次热循环(升温至Tg+5°C后复测)
含水量检测(卡尔费休法)
4. 操作流程:
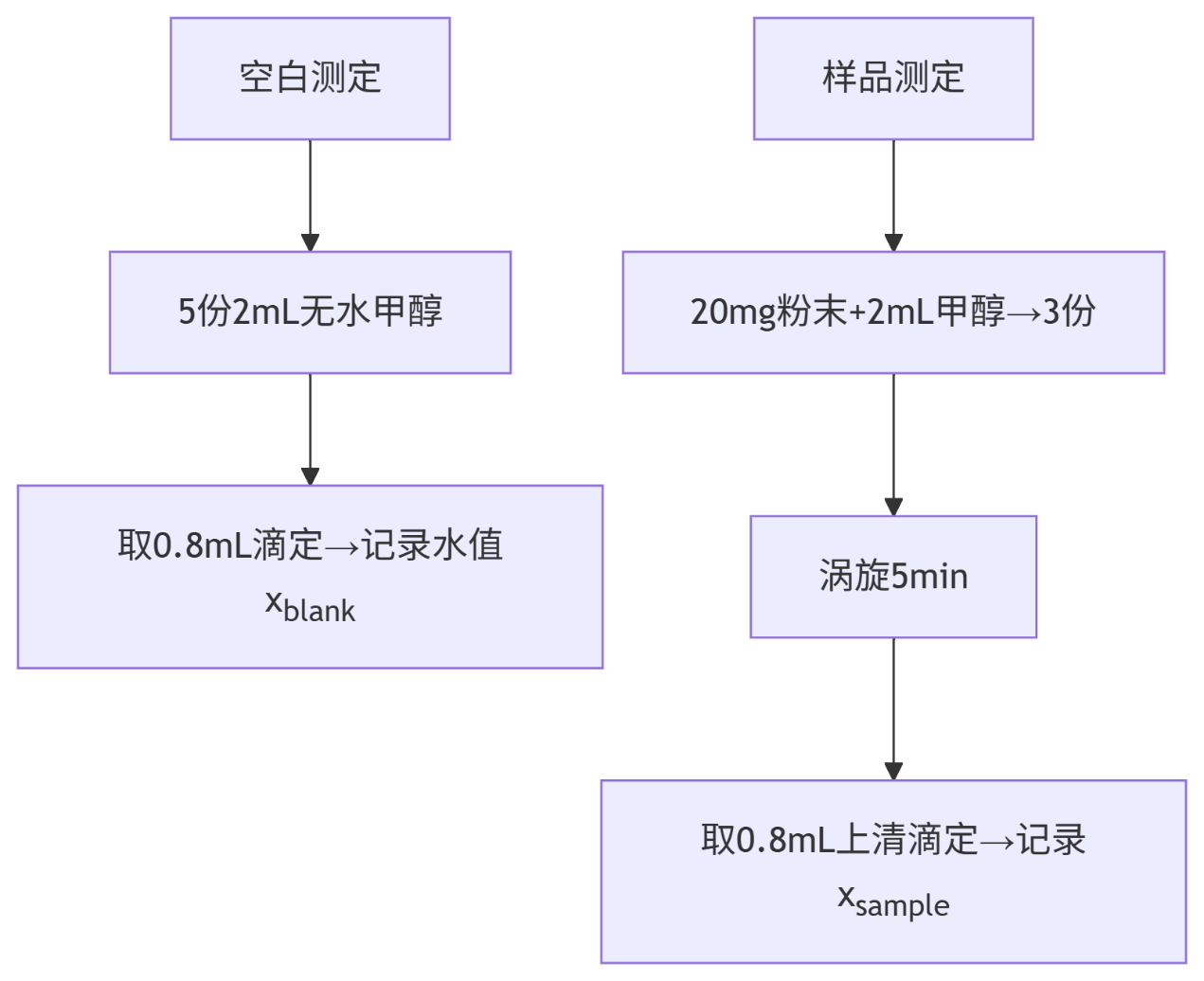
5. 含水量计算公式:含水量(%)=[(xsample/msample−acerage(xblank/mblank)]×mmethanol)/ mpowder
(展示预冻与主干燥阶段的参数动态变化)
监测变量:
• 载冷剂(层板)温度
• 冷阱温度
• 不同位点样品温度(Th1–Th5)
• 腔室压力(皮拉尼规与电容规双测值)
本节总结:乳酸菌冻干全流程控制要点
工艺设计三原则
| 原则 | 实现方式 | 目标值 |
|---|---|---|
| 无菌保障 | 滤膜除菌/121°C灭菌 | 微生物零污染 |
| 热敏感保护 | 抗坏血酸钠避光操作 | 抗氧化活性保留 |
| 结构保全 | 阶梯升温+真空联动 | 塌陷温度Tcoll+5°C内 |
冻干工艺参数优化表
| 阶段 | 核心参数 | 安全范围 | 监控手段 |
|---|---|---|---|
| 预冻 | 降温速率 | 0.5-1°C/min | 热电偶实时反馈 |
| 主干燥 | 层板温度/真空度 | -10°C/10 Pa | 双真空计差值判定 |
| 解析干燥 | 升温速率/最终温度 | 0.25°C/min → 25°C | 压力-温度关联曲线 |
| 储存 | 温度 | Tg-20°C | DSC测定Tg |
质量判定金标准
| 指标 | 合格范围 | 检测方法 |
|---|---|---|
| 水活度aw | ≤0.2 | 水活度仪 |
| 含水量 | ≤3% | 卡尔费休滴定 |
| Tg | ≥储存温度+20°C | DSC |
通过此标准化流程,可实现乳酸菌冻干存活率>90%,复溶时间<30秒,保质期≥2年。
4 技术注释
无菌与操作规范
| 条目 | 要点说明 |
|---|---|
| 1. 设备清洁 | 非强制灭菌,但需批次间彻底清洁消毒(避免交叉污染) |
| 8. 无菌操作 | 层流罩内转移菌体;无层流条件时使用酒精灯操作 |
| 2. 非无菌条件 | 若无需检测生物活性(存活率/产酸),3.1节步骤2-5可在非无菌下进行(全程4°C保冷) |
离心与菌泥处理
3. 离心参数 | 离心力/时间按菌种调整,温度保持2-4°C
6. 菌泥洗涤 | 弃上清后加等体积生理盐水→重悬→再离心(可重复1次)
保护剂配方关键
5. 配方调整原则
- 溶质总浓度≤250 g/L(过高损伤细胞)
- 冻干后生物活性检测决定最终优化方向
7. 抗氧化剂 | 氧化敏感菌株需增至10 g/L抗坏血酸钠
冻干工艺精控
9. 预冻替代方案 | -80°C冰箱/液氮冷冻→层板预冷至-50°C后装载
10. 温度监测
- 热电偶布点:容器中心+边缘(层板中心+边缘)
- 边缘样品温度可能高4°C[19,20]
11-12. 参数优化
- 主干燥(升华):层板温度/真空度依设备调整
- 解析干燥:升温速率/时间按配方敏感性优化
检测注意事项
13. 干操环境 | 所有检测耗材提前24h置干燥空气舱平衡
14. 卡尔费休法
- 不溶样品需静置分层(避免残渣进滴定池)
- 仅取上清液检测
4. DSC双转变峰
- Tg'1:最大冻结浓缩相玻璃化起始温度
- Tg'2:体系自重下发生黏性流动的温度
本节小结:冻干工艺三大风险控制
1. 生物活性保障
2. 工艺均一性控制
| 风险点 | 解决方案 |
|---|---|
| 温度分布不均 | 层板中心+边缘双点位监测 |
| 边缘过热 | 降低层板温度补偿(-4°C) |
| 升华终点误判 | 皮拉尼规+电容规双数据比对 |
3. 检测数据可靠性
| 检测项 | 误差控制措施 |
|---|---|
| 水活度 | 干操环境+25°C预平衡 |
| 含水量 | 甲醇空白校正+三重复检测 |
| Tg | 二次热循环消除热弛豫干扰 |
通过严守250 g/L保护剂浓度上限、解析干燥阶梯升温(0.25°C/min)、储存温度≤Tg-20°C,可保障乳酸菌冻干存活率>85%,货架期≥24个月。
总结
本文系统阐述了乳酸菌冷冻干燥过程中保护剂配方开发与工艺优化的科学方法。通过聚焦玻璃化转变温度(Tg')和塌陷温度(Tcoll)等关键物性参数,结合DSC与冻干显微镜技术,提出了基于细胞存在可提升Tcoll特性的配方设计策略。文章建立了从保护剂筛选、物性测定、冻干工艺设定到产品稳定性评价的完整流程,强调配方与工艺协同优化的重要性。最终目标是实现高细胞存活率、良好复溶性与长期储存稳定性,为益生菌等高值生物制品的工业化冻干提供理论依据与实践指导。
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-08-17
编制人:小灰
审稿人:小藻
