微生物保藏中心技术基石:冷冻保存与真空冻干操作规程
来源:武汉市灰藻生物科技有限公司 浏览量:467 发布时间:2025-07-11 20:31:38
引言
本文译自国际权威著作《冷冻保存与冻干保存操作规程(第二版)》(*Cryopreservation and Freeze-Drying Protocols, 2nd ed.*)
第1章《生物资源的长期异地保藏与生物资源中心的作用》
作为生物资源保藏单位,我们系统编译此内容旨在:
1、夯实理论基础——解析生物资源中心(BRCs)的战略价值与质量标准
2、共享国际经验——引进全球顶尖保藏机构的技术规范与管理框架
3、服务行业发展——为科研院所、生产企业提供标准化操作参考
后续更新预告
本系列将持续发布核心章节译文:
• 第2章:冷冻干燥物理机制
• 第3章:冷冻保存生物学原理
• 第5章:原核生物真空干燥与冷冻保存
• 第6章:酵母菌株的冷冻干燥
• 第7章:酵母菌株的冷冻保存
• 第8章:真菌搁板式冷冻干燥
• 第9章:真菌离心/搁板式冷冻保存技术
构建覆盖微生物保藏全链条的技术知识库
生物资源中心(biological resource centers,BRCs)的建立与维护,需严格实施可靠的保存技术及质量控制体系,确保复苏的培养物和生物样本,与原始分离时性能一致。生物资源中心类型多样,其保藏种类与目的各不相同。所有BRCs均须根据应用需求,提供符合质量标准的材料与信息,并遵循相关应用标准运作。唯有通过BRCs长期高效运作,方能解决关键的工业、生物医学及物种保护问题。这要求具备超高专业能力,通过超低温保存或冷冻干燥技术维护生物样本库,确保其长期完整性及对未来研究、开发和保护的价值。
关键词:生物资源中心;保存;微生物;细胞系;组织
1. 背景介绍
数个世纪以来,收集各类生物样本(或称之为“保藏”),始终是科学家与业余收藏者的追求。保藏最初源于人类对自然环境多样性的好奇,而近一个多世纪以来,科学家为满足分类学、传染病学及生物化学等特定科技目标,系统收集了动物、植物及微生物。首例工业用微生物菌种库,由Kral于1869年建立,此后基于实验室或野外受控条件保藏的各类菌株/物种资源库逐步发展。
生物保藏面临诸多挑战:生物体对体外环境的适应性改变、基因突变、污染及培养物意外丢失等。显然,需一种能阻断生长,以降低风险的保藏机制。
19世纪科学知识与工程能力的爆发式增长,催生了新技术,包括气体压缩液化技术,推动低温生物学领域迅速发展。人类利用超低温防止生物材料降解的实践,可追溯至数千年前,而17-18世纪的科学观察,为20世纪冷冻保存技术的突破奠定基础。这些成就最终形成了可靠的原核与真核生物保存方法,使其能以"生命悬停"状态长期存活且性状不变。细菌与真菌保存技术由19世纪至20世纪初的先驱者确立,随后Polge等(1)对动物细胞的保存研究,及Sakai(2)对植物细胞的突破性工作,成为冷冻保存技术发展的关键里程碑。随着低温生物学基础研究的深入与新方法的迭代,保存技术持续优化,现已能处理本书方案所涉的多样化复杂细胞与组织培养物。
当今的培养物保藏机构(更广义的生物资源中心)融合学术、公共服务、私营、政府及商业职能,提供重要特征明确的"种子"资源:
1、工业流程开发
2、生物检测与科学文献的参考菌株
3、分类学研究的模式菌株
4、生物多样性保护中心
本章将阐述建立并长期维护冷冻保存生物材料库的核心原则与挑战。
2. 生物资源中心的基本原则
生物材料库必须维持三大核心特性,以确保存储材料的价值:
(1) 纯度(无污染生物体);
(2) 真实性(菌株身份准确);
(3) 稳定性(含功能特性完整)。
纯度
对避免数据偏差至关重要。然而,某些生物体因与其他生物存在腐生共生关系(如特定原生生物、腐生真菌)无法在纯培养条件下存活,或必须依赖宿主细胞保存(如疟原虫(3)),此时纯度确认极为困难。
真实性
通常基于特定稳定的表型或基因型特征,不同生物类群标准各异。部分DNA分析技术(如多位点DNA指纹图谱、短串联重复序列分析(4))及基因测序方法(如细胞色素c氧化酶测序(5)、核糖体分型(6))提供了可跨物种应用的通用鉴定方案。
稳定性
对体外培养物而言,连续传代导致的表型与基因型漂变是严重隐患,已知病毒、病原菌及细胞系(7)长期培养后,会发生不可逆变异。
因此,BRCs须通过标准化操作,确保保藏与分发样本维持上述特性,具体措施包括:
• 为每个生物体建立主库(Master Bank)与分发库(Distribution Bank)(图1)(8)
• 实施稳健的质量控制体系,验证各库符合既定标准
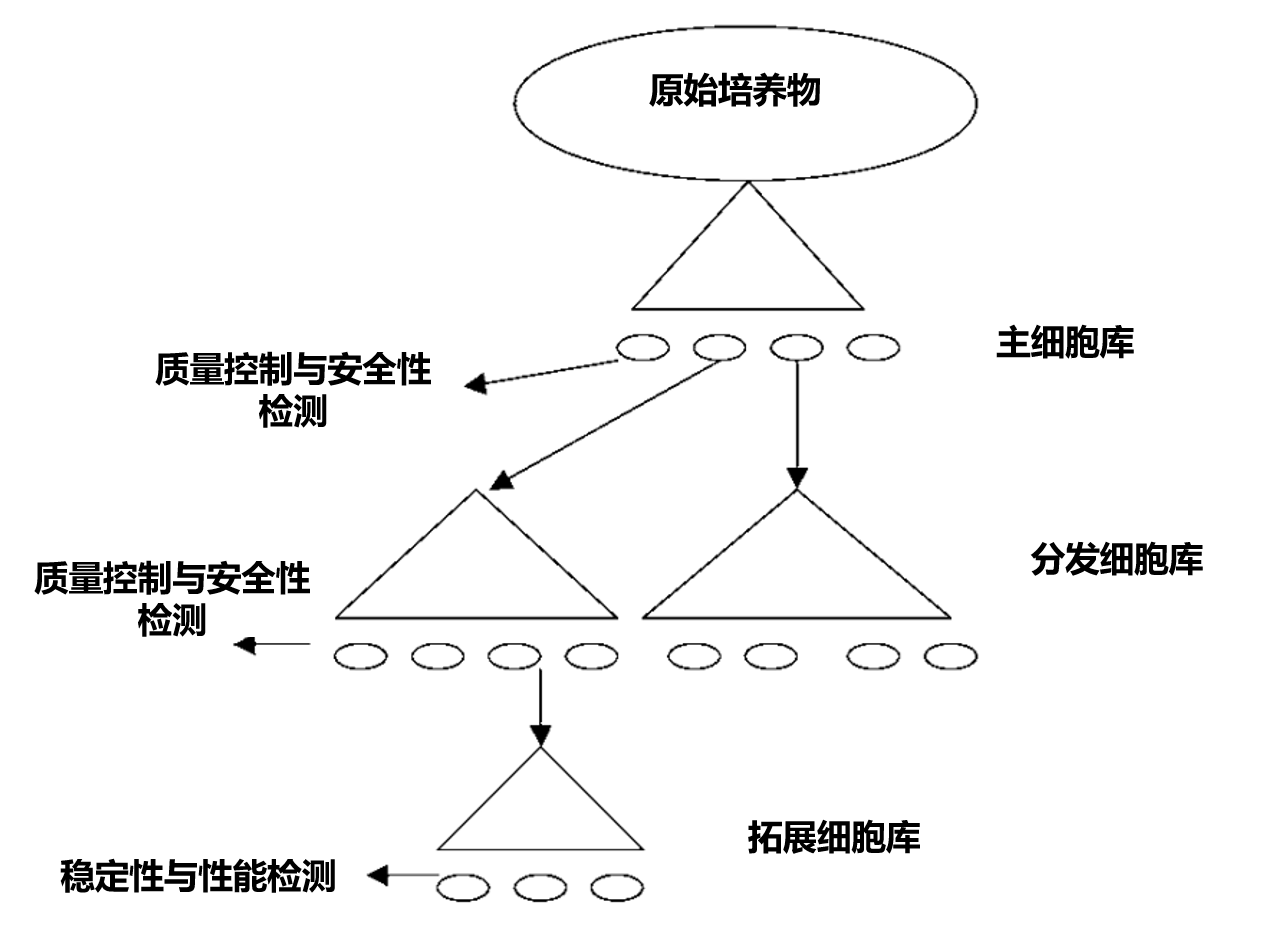
图1. "主库"与"工作库"(或称"分发库")体系示意图
每个"库"由若干容器(◯)组成,容器内封装均质混合单批次收获细胞的冷冻保存样本。建立拓展细胞库可实现平行实验中不同传代次数的培养特性检测。该库体系能确保:
1. 培养物分发至研究人员前,经历尽量少的传代次数
2. 作为工艺流程图基础,构建溯源流程与质控体系(9)
质控方案需根据培养物特性动态调整,并基于双重风险评估制定:
1. 特定培养物的历史背景
2. 同类培养物的科学认知经验(风险评估要素示例见表1)
表1 生物资源中心适用标准对照
| 特性 | 细菌菌株典型方法 | 植物种质典型方法 | 动物细胞系典型方法 |
|---|---|---|---|
| 纯度 | 肉汤/琼脂培养验证纯生长 | 肉汤/琼脂培养确认无细菌/真菌污染 | 肉汤/琼脂培养确认无菌生长 (12) 支原体检测 (12) 病毒污染检测(如电镜、分子检测、动物或测试细胞系接种)(13) |
| 真实性 | 革兰氏染色、菌落形态、生化基因分型、生化反应、核糖体基因序列 | 细胞/结构形态学、基因型、次生代谢产物表达谱、DNA基因型 (10) | DNA指纹图谱、核型分析、同工酶分析、细胞色素c氧化酶序列 (4) |
| 稳定性 | 抗生素敏感性、基因测序确认无突变 | 保持植株再生能力、次生代谢产物持续表达、无芽变现象 (10,11) | 杂交瘤抗体分泌能力、病毒易感性、核型分析 |
上述要求已被纳入培养物保藏机构的最佳实践指南。该标准规定了BRCs材料质量的最低保证基准,而优质BRCs通常执行更高标准。此外,特定细胞培养类型存在专项技术指南,部分BRCs还需遵守具法律效力的法规与伦理规范(详见表2)。
表2 细胞库建设标准体系
| 培养物类型/应用场景 | 适用标准 |
|---|---|
| 研发用途 | 国家病原体操作/防护/处置法规 国家转基因生物法规 良好细胞培养规范 (15) |
| 专利保藏生物材料 | 《布达佩斯条约》 (16) |
| 植物细胞与组织 | 国家及国际病原体进出口条例 (http://www.wfcc.info) 濒危物种贸易公约 (http://www.cites.org/) |
| 动物细胞与组织 | 国家许可证/操作流程/人员培训记录法规 国家及国际病原体与濒危物种进出口条例(参见上文) |
| 研究用人源细胞与组织 | 国家伦理获取与项目审批法规 |
| 移植治疗用人源细胞与组织 | 国家及国际伦理获取/处理/存储规范 (17) |
| 人用治疗产品生产用生物体及细胞系 | 国际细胞基质规范 (18,19) |
| 检测用生物体及细胞系 | 国际生物武器扩散管制条例 国际产品检测规范(如OECD良好实验室规范 (20)、药典专论 (http://www.usp.org/ 或 http://www.pheur.org/) |
3. 生物资源中心的长期核心价值
BRCs提供的培养物若缺乏身份、来源及特性信息,其价值将大打折扣。培养物保藏机构作为重要的生物信息存储库,可通过直接联系各机构获取数据。随着BRCs培养物研究成果的持续发表,该信息资源库将不断扩充。
BRCs同时致力于培养物保藏技术的研发创新,且常为此类专业研发的唯一基地。因此,BRCs已成为生物安全、样本运输、特征鉴定、保存技术及分类学等前沿信息的权威来源(参见www.wfcc.info),并积极推动相关领域的培训教育。
众多BRCs通过保存濒危植物组织(第12章)、种子(第13章)及动物配子与胚胎(第21-23章),为生物多样性异地保护提供关键服务。这类中心具备再生已灭绝物种的潜力。生物技术与生物医学领域同样依赖活性细胞的长期存储,以确保产品生产与检测的可靠种子资源。此外,长期存储对知识产权保护至关重要——通过支持专利应用(要求保存细胞至少维持30年活性(16,21))实现技术确权。
4. 确保长期存储成功
4.1 经验与关键问题
普遍认为生物体在液氮中成功冷冻保存后,将在超低温下无限期维持活性。本书多位作者援引文献证实:冷冻保存生物体可成功存储数十年(表3)。但该结论基于存储温度稳定维持液氮温度(–196°C) 的前提。实际上:
• 气相存储无法达到此温度
• 液氮液位波动导致温度变化
核心警戒值:存储温度不可超过
➤ 冷冻细胞悬液的熔点
➤ 玻璃化材料的玻璃化转变温度(参见第2-3章)
反复短暂暴露于环境温度,将导致活性丧失。
因此,需通过以下措施,保障长期活性:
✅ 定期检查液氮液位与罐体填充计划
✅ 实施人员标准化培训 (18)
表3 保存生物材料长期活性实例
| 生物分类/材料 | 保存方式 | 存储时长 | 活性表现 | 参考文献 |
|---|---|---|---|---|
| 细菌 | 5–35年(长期) | 存活,活性无衰减 | 22 | |
| 19株酵母菌 | LN | |||
| 酵母 | FD | >30年 | 存活,活性良好 | 第6章 |
| 真菌 | FD | 24 | ||
| 粟酒裂殖酵母 | LN | 10年 | 基因型未改变 | 第7章 |
| 多种微藻 | LN | >20年 | 活性无衰减 | 25 |
| 多种蓝细菌 | LN | >20年 | 活性无明显丧失 | Rippka(个人通讯) |
| 莴苣种子 | LN | >10年 | 活性未丧失,半衰期约3400年 | 26 |
| 干细胞 | LN | 15年 | 高复苏率 | 27 |
| 人与绵羊红细胞 | LN | 12年 | 功能无退化 | 第20章 |
| 人造血干细胞 | LN | 14年 | 保留植入潜能 | 28 |
| 牛精子 | LN | 37年 | 运动力正常,成功受精 | 29 |
| 人精子 | LN | 5年 | 质量无统计学下降 | 30 |
| 人精子 | LN | 21年 | 成功受精并活产 | 31 |
| 犬胰岛 | LN | 6个月 | 胰岛素分泌无减少 | 32 |
| 绵羊胚胎 | LN | 5年 | 活产率与存储2周组无差异 | 33 |
| 绵羊胚胎 | LN | 13年 | 活产率与存储1月组无差异 | 34 |
缩写:FD, 冷冻干燥;LN, 液氮存储
4.2 存储设施
细胞库建设需匹配安全、洁净、稳定的存储环境,并保障人员安全 (15)。安全管理体系包括:
| 措施 | 功能 |
|---|---|
| 权限管控 | 限制非授权人员访问 |
| 液氮罐报警系统 | 实时监测异常 |
| 填充维护规程 | 标准化操作文档化 |
存储模式选择需权衡:
| 存储方式 | 优势 | 风险 |
|---|---|---|
| 液相存储 | 温度最低最稳定(理论最优) | 病原体交叉污染风险 (35) |
| 气相存储 | 操作便利安全性高 | 温度波动风险 |
| 电气冰箱 | 免维护实用性强 | 频繁存取导致温度扰动 |
特别警示:
• 液氮操作需专业培训(冻伤、安瓿爆炸、窒息风险)
• 密闭空间需配备个人氧气监测仪
• 危险物/隔离物/归档物分区存储
4.3 存储材料信息化
精准记录是高效检索的基础,对转基因/感染性材料更是法定要求。建议:
• 选用可定制化商用数据库系统
• 存储现场,实时更新存取记录(避免转录错误)
• 定期备份电子数据与纸质副本
4.4 长期存储其他问题
污染防控:
• 定期清理液氮罐冰泥(微生物污染源)(36)
• 采用安瓿双重密封或存储盒防护
• 警惕液氮中容器破损导致的致命病毒交叉感染 (35)
辐射影响:
自然辐射虽被视为潜在风险,但维护良好的液氮罐中长期存储(即使对胚胎等敏感系统 (37))未见不良反应证据
灾备策略:
1. 重要归档材料分罐存储
2. 建立异地备份存储点
3. 在温度易波动区(如库存系统顶层)设置"哨兵库" (38)
4. 采用RFID技术 (39) 实时监测单管温度履历
注:加速热稳定性研究可预测超低温存储活性(参见第4、13章 (40))
表4 典型冷冻保存材料的存储与运输条件
| 材料类型 | 存储条件 | 运输条件 |
|---|---|---|
| 冷冻干燥蛋白质、细菌、真菌 | 通常≤4°C存储(取决于热稳定性) | 可常温运输(取决于稳定性) |
| 冷冻保存细胞/生物体(瓶装或安瓿) | 通常<-100°C存储: • 电气冰箱(-100至-150°C) • 液氮液相/气相(-160至-196°C) *注:-80°C存储活性随时间递减(41)* | 干冰包装运输(-80°C) 关键:确保干冰足量维持全程冷冻 专业物流公司可补充干冰 |
| 移植用冷冻组织/细胞 | 通常液氮气相存储(避免浸没液相以防污染) | 专用"干式运输罐"维持液氮气相温度 |
| 玻璃化保存细胞(参见第3、12章) | 存储温度低于特定保存方法及细胞的玻璃化转变温度(参见第2、3章) | 必须低于玻璃化转变温度(如使用吸附液氮的干式运输罐) 干冰等较高温度会导致反玻璃化及活性丧失 |
缩写:LN, 液氮存储
5. 结论
通过专业生物资源中心(BRCs)获取经质量认证的真实生物材料与培养物,对推动科研标准化、提升效率及保障实验室安全具有显著优势。培养菌株已成为工业和生物医学工作的专业标准,且可能需稳定存储数十年,以支持物种保护计划、生产过程、检测方法及专利维护。
即使冷冻保存技术尚未针对所有待保藏生物体优化,BRCs仍面临为海量菌株提供低温存储的挑战。随着细胞体外实验技术的发展与扩张,对保存及培养专业技能的需求日益增长,BRCs将持续作为专业咨询与培训的核心基地。
6. 参考文献
• (1) Polge, C., Smith, A. U., and Parkes, S. (1949) Revival of spermatozoa after dehydration at low temperatures. Nature (London) 164, 166.
• (2) Sakai, A. (1966) Survival of plant tissues at super-low temperatures. IV. Cell survival with rapid cooling and rewarming. Plant Physiol. 41, 1050–1054.
• (3) Mutetwa, S. M. and James, E. R. (1984) Cryopreservation of plasmodium chabaudi. II. Cooling and warming rates. Cryobiology 21, 552–558.
• (4) Stacey, G. N., Byrne, E., and Hawkins, J. R. (in press) DNA fingerprinting and characterisation of animal cell lines. In: Methods in Biotechnology, vol. 8, Animal Cell Biotechnology: Methods and Protocols, 2nd ed. (Poertner, R., ed.), Humana Press, Totowa, NJ.
• (5) Hebert, P. D., Cywinska, A., Ball, S. L., and deWard, J. R. (2003) Biological identifications through DNA barcodes. Proc. Biol. Sci. USA 270, 313–321.
• (6) Bingen, E. H., Denamur, E., and Elion, J. (1994) Use of ribotyping in epidemiological surveillance of nosocomial outbreaks. Clin. Microbiol. Rev. 7, 311–327.
• (7) Stacey, G. N. (2002) Standardisation of cell lines. Dev. Biologics 111, 259–272.
• (8) Hay, R. J. (1988) The seed stock concept and quality control for cell lines. Anal. Biochem. 171, 225–237.
• (9) Stacey, G. N. (2004) Validation of cell culture media components. Human Fertility 7, 113–118.
• (10) Harding, K. (2004) Genetic integrity of cryopreserved plant cells: a review. CryoLetters 25, 3–22.
• (11) Stacey, G. N., Benson, E. E., and Lynch, P. T. (1999) Plant gene-banking: agriculture, biotechnology, and conservation. Agro-Food-Industry Hi-Tech. 10, 9–14.
• (12) Stacey, A. and Stacey, G. N. (2000) Routine quality control testing for cell cultures. In: Methods in Molecular Medicine, vol. 24, Antiviral Methods and Protocols, (Kinchington, D. and Schinazi, R. F., eds.), Humana Press, Totowa, NJ, pp. 27–40.
• (13) McLean, C. (2000) Contamination detection in animal cell culture. In: Encyclopedia of Cell Technology, (Spier, R., editor in chief), Wiley Interscience, New York, NY, pp. 586–609.
• (14) World Federation for Culture Collections (1999) Guidelines for the establishment and operation of collections of cultures of microorganisms, 2nd ed., 1999 (ISBN 92 9109 043 3).
• (15) Coecke, S., Balls, M., Bowe, G., et al. (2005) Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. ATLA 33, 1–27.
• (16) Budapest Treaty Regulations (1977) Budapest Treaty on the International Recognition of the Deposit of microorganisms for the Purposes of Patent Procedure. 277 (E), World Intellectual Property Organisation, Geneva, Switzerland, 1981.
• (17) EU (2004) Directive 2004/23/EC of the European Parliament and the Council of 31 March 2004 on setting standards of quality and safety for the donation, processing, preservation, storage and distribution of human tissues and cells. Official Journal of the European Union, L102; 48–58.
• (18) World Health Organization expert committee on biological standardization and executive board (ECBS) (2005) Requirements for the use of animal cells as in vitro substrates for the production of biologicals. Technical Report Series 927, World Health Organization, Geneva, Switzerland.
• (19) ICH (1997) Human medicines evaluation unit: ICH topic Q 5 D -quality of biotechnological products: derivation and characterisation of cell substrates used for production of biotechnological/biological products. European Agency for the Evaluation of Medicinal Products, ICH Technical Co-ordination, London, 1997. (http://www.eudra.org/emea.html).
• (20) OECD (2004) Draft advisory document of the OECD working group on the application of GLP principles to in vitro studies. OECD, Paris, France, pp. 18.
• (21) Stacey, G. N. (2004) Cell line banks in biotechnology and regulatory affairs. In: Life in the Frozen State, (Fuller, B., Benson, E. E., and Lane, N., eds.), CRC Press LLC, Boca Raton, FL.
• (22) Rudge, R. H. (1991) Maintenance of bacteria by freeze-drying. In: Maintenance of microorganisms and cell cultures, 2nd ed., (Kirsope, B. E. and Doyle, A., eds.), Academic Press, London, UK, pp. 31–44.
• (23) Hubalek, Z. and Kockova-Kratochvilova, A. (1982) Long term preservation of yeast cultures in liquid nitrogen. Folia Microbiologia 27, 242–244.
• (24) Smith, D. and Onions, A. H. S. (1994) The Preservation and Maintenance of Living Fung, 2nd ed. CAB International, Wallingford, UK.
• (25) Day, J. G., Watanabe, M. M., Morris, G. J., Fleck, R. A., and McLellan, M. R. (1997) Long-term viability of preserved eukaryotic algae. J. Appl. Phycol. 9, 121–127.
• (26) Walters, C., Wheeler, L., and Stanwood, P. C. (2004) Longevity of cryogenically stored seeds. Cryobiology 48, 229–244.
• (27) Broxmeyer, H. E., Srour, E. F., Hangoc, G., Cooper, S., Anderson, S. A., and Bodine, D. M. (2003) High-efficiency recovery of functional hematopoietic progenitor and stem cells from human cord blood cryopreserved for 15 years. Proc. Natl. Acad. Sci. USA 100, 5645–5650.
• (28) Spurr, E. E., Wiggins, N. E., Marsden, K. A., Lowenthal, R. M., and Ragg, S. J. (2002) Cryopreserved human haematopoietic stem cells retain engraftment potential after extended (5–14 years) cryostorage. Cryobiology 44, 210–217.
• (29) Leibo, S. P., Semple, M. E., and Kroetsch, T. G. (1994) In-vitro fertilization of oocytes by 37-year-old cryopreserved bovine spermatozoa. Theriogenology 42, 1257–1262.
• (30) Rofeim, O. and Gilbert, B. R. (2005) Long-term cryopreservation of human spermatozoa. Fertility and Sterility 84, 536–537.
• (31) Horne, G., Atkinson, A. D., Pease, E. H. E., Logue, J. P., Brison, D. R., and Lieberman, B. A. (2004) Live birth with semen cryopreserved for 21 years prior to cancer treatment. Human Reproduction 19, 1448–1449.
• (32) Chern, H. T. and Scharp, D. W. (1995) Successful long-term cryopreservation of highly purified canine islets. Eur. Surgical Res. 27, 167–175.
• (33) Salamon, S. and Vissier, D. (1974) Fertility after surgical insemination with frozen boar semen. Aus. J. Biol. Sci. 27, 499–504.
• (34) Fogarty, N. M., Maxwell, W. M. C., Appleton, J., and Evans, G. (2000) The viability of transferred sheep embryos after long-term cryopreservation. Repro. Fert. Dev. 12, 31–37.
• (35) Tedder, R. S., Zuckerman, M. A., Goldstone, A. H., et al. (1995) Hepatitis B transmission from a contaminated cryopreservation tank. Lancet 346, 137–140.
• (36) Fountain, D., Ralston, M., Higgins, N., et al. (1997) Liquid nitrogen freezers: a potential source of microbial contamination of hematopoietic stem cell components. Transfusion 37, 585–591.
• (37) Glenister, P. H., Whittingham, D. G., and Lyon, M. F. (1984) Further studies on the effect of radiation during storage of frozen 8-cell mouse embryos at –196 degrees C. J. Reprod. Fert. 70, 229–234.
• (38) Stacey, G. N. (1999) Control of contamination in cell and tissue banks. CryoLetters 20, 141–146.
• (39) Streit, S., Bock, F., Pirk, C. W., and Tautz, J. (2003) Automatic life-long monitoring of individual insect behaviour now possible. Zoology (Jena) 106, 169–171.
• (40) Kirkwood, T. B. L. (1984) Design and analysis of accelerated degradation tests for the stability of biological standards, III Principles of design. J. Biol. Stand. 12, 215–224.
• (41) Ratajczak, M. Z., Kegnow, D. A., Kuczynski, W. I., Ratajczak, J., and Gewitz, A. M. (1994) The storage of cells from different tumor lines in a mechanical freezer at -80 degrees C. Comparison to cryopreservation in liquid nitrogen. Mater. Med. Pol. 26, 69–72.
总结
本章确立生物资源中心(BRCs)作为资源库的四大支柱作用:
| 职能维度 | 技术内涵 | 行业价值 |
|---|---|---|
| 质量中枢 | 主库/分发库三级体系 ▶ 纯度/真实性/稳定性控制 ▶ 国际标准合规(ISO/WFCC) | 保障科研数据可重复性与产业标准化 |
| 信息枢纽 | 菌株溯源数据库 ▶ 跨机构数据共享 ▶ 专利生物材料保藏(布达佩斯条约) | 支撑知识产权保护与技术创新 |
| 技术引擎 | 液氮深冷存储优化 ▶ 气相/液相风险管控 ▶ 哨兵库监测 ▶ RFID温度追溯 | 破解海量菌株长期活性维持难题 |
| 物种方舟 | 濒危生物冷冻保护(种子/配子/胚胎) ▶ 灭绝物种再生潜能 | 履行生物多样性保护国际责任 |
实践启示:
• 超低温存储,需建立灾备三防线(分罐存储+异地备份+拓展库)
• 微生物保藏优先选择冷冻干燥(常温存储)与液氮气相(安全存取)
• 质量体系必须覆盖全生命周期(采集→存储→运输→复苏)
本章为后续微生物保藏技术(第2、3、5-9章)奠定核心方法论基础,敬请关注专题更新。
敬请关注“灰藻生物”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-07-11
编制人:小灰 | 审稿人:小藻
