用工程化的杨氏梭菌(Clostridium ljungdahlii)将二氧化碳转化为丁酸的技术路径
来源:武汉市灰藻生物科技有限公司 浏览量:4 发布时间:2026-01-30 15:15:24
引言
通过合成气代谢或微生物电合成,将二氧化碳经微生物转化为有机大宗化学品,是生产可再生生物基产品的极具吸引力的途径。
近期针对产乙酸菌杨氏梭菌(Clostridium ljungdahlii)初步构建的遗传操作工具箱表明,该菌株有望成为此类转化的有效底盘细胞。 为验证这一可能性,研究人员对其进行了工程化改造,使其能够合成丁酸
——一种具有高附加值但并非* C. ljungdahlii* 天然代谢产物的大宗化学品。
技术路径
首先鉴定了从乙酰辅酶A(acetyl-CoA)合成丁酸所需的异源基因,并将其初步以质粒形式导入,随后进一步整合至 C. ljungdahlii 染色体中。
通过多轮迭代的菌株设计,研究人员采取了以下策略:
1、通过修饰核糖体结合位点(RBS)增强关键酶的翻译效率;
2、敲除编码乙酰辅酶A向乙酸转化第一步反应的基因(ack)
3、破坏编码主要双功能醛/醇脱氢酶(AdhE)的基因,以阻断乙醇生成途径
4、中断一个编码辅酶A转移酶(CoA transferase)的基因,该酶可能构成另一条乙酸生成的替代路径
上述改造最终获得了一株高效产丁酸的工程菌株:当以 H₂ 或 CO 作为电子供体时,分别约有 50% 或 70% 的碳流与电子流被导向丁酸合成。 该结果充分证明,以 C. ljungdahlii 为生物催化剂,可实现从二氧化碳高效生产高价值化学品,为碳资源的可持续利用提供了重要技术路径。
材料与方法
菌株与培养条件
本研究以德国微生物及细胞保藏中心(DSMZ)提供的杨氏梭菌(Clostridium ljungdahlii DSM 13528),作为丁酸生产工程改造的亲本菌株。
当以果糖作为碳源和能源时,菌株在 PETC 1754 培养基中培养,顶空气氛为 100% CO₂,培养基中添加 28 mM 果糖。
当以一氧化碳(CO)作为电子供体时,PETC 1754 培养基中不添加果糖,并向培养管顶空中充入 CO 至压力为 20 psi(磅/平方英寸)。
当以氢气(H₂)作为电子供体时,菌株在 DSMZ 879 培养基中培养,不添加果糖,顶空气氛为 H₂–CO₂(80%/20%,体积比),并进一步将该混合气体加压至 20 psi。
采用 DSMZ 879 培养基是为了维持体系中 CO₂ 的分压,因其原始配方的顶空气氛为 N₂–CO₂(80%/20%)。
所有培养均在厌氧耐压试管(27 mL)中进行:果糖培养条件下加入 10 mL 培养基,而 CO 或 H₂ 培养条件下则加入 5 mL 培养基。
以 CO 或 H₂ 为底物的培养物置于摇床中,转速为 100 rpm。 大肠杆菌(Escherichia coli)NEB 5-alpha 和 NEB Express(New England Biolabs 公司)用于质粒制备,培养方法按照厂商说明书进行。
丁酸合成途径基因在质粒中的构建(菌株 B1 和 B2)
从乙酰辅酶A(acetyl-CoA)合成丁酸所需的 Clostridium acetobutylicum 基因(见补充材料Figure 1)通过 PCR 扩增获得。
扩增的基因包括:thl(NCBI GenBank 登录号 CA_C2873)、crt(CA_C2712)、bcd(CA_C2711)、etfB(CA_C2710)、etfA(CA_C2709)、hbd(CA_C2708)、buk(CA_C3075)和 ptb(CA_C3076)。所用 PCR 引物列于补充材料Table S1。 PCR 产物首先克隆至 pCR-Blunt II-TOPO 载体(Life Technologies)。
随后,含 etfA 的 NdeI–PstI 片段被插入至含 bcd 和 etfB 的 pCR-Blunt II-TOPO 载体的 NdeI(位于 etfB 内部)和 PstI 位点。含 thl 的 KpnI–XhoI 片段被克隆至 pBluescript II KS(−)(Stratagene)的 KpnI 和 XhoI 位点。接着,含 crt 的 XhoI–EcoRI 片段被插入至已含 thl 的 pBluescript II KS(−) 的 XhoI 和 EcoRI 位点。随后,含 bcd、etfB 和 etfA 的 EcoRI–PstI 片段被克隆至含 thl 和 crt 的 pBluescript II KS(−) 的 EcoRI 和 PstI 位点。含 hbd 的 PstI–BamHI 片段则被插入至已含 thl、crt、bcd、etfB 和 etfA 的 pBluescript II KS(−) 的 PstI 和 BamHI 位点(见补充材料Figure S1A)。
最终,含 thl、crt、bcd、etfB、etfA 和 hbd 的 KpnI–BamHI 片段被克隆至表达载体 pJe-p 的 KpnI 和 BamHI 位点(见补充材料Figure S2)。同时,含 ptb 和 buk 的 BamHI–SalI 片段被插入至 pM6-p 载体的 BamHI 和 SalI 位点(见补充材料Figure S2)。 pJe-p 和 pM6-p 的构建方法如下:将来自 C. ljungdahlii 的 pta 基因推定启动子分别插入至 pJe和 pMTL82151(由 N. P. Minton 惠赠)中。
其中,pJe 是 pCL2的衍生载体,其氯霉素抗性基因被红霉素抗性基因(ermC)替代。pta 启动子通过使用补充材料Table S1 所列引物进行 PCR 扩增获得,产物克隆至 pCR-Blunt II-TOPO;随后,含该启动子的 EcoRI–KpnI 片段被插入上述载体的相应位点。
丁酸途径基因整合至染色体(菌株 B3)
如前所述,从含 ptb 和 buk 的 pCR-Blunt II-TOPO 载体(buk 下游含 BamHI 位点)切下的 BamHI 片段,被克隆至含 thl、crt、bcd、etfB、etfA 和 hbd 的 pBluescript II KS(−) 载体的 BamHI 位点(见补充材料图 S1B)。此处使用的 crt 基因含有经修饰的核糖体结合位点(RBS)。buk 上游保留了一个 SalI 位点,位于 BamHI 位点之前。
所得质粒中,ptb 和 buk 与 thl、crt、bcd、etfB、etfA、hbd 位于同一转录方向,用于后续质粒构建。ermC 基因通过以 pCL1(18)为模板、使用表 S1 引物进行 PCR 扩增获得,产物克隆至 pCR-Blunt II-TOPO。随后,含 ermC 的 SpeI–NotI 片段被插入至含全部丁酸途径基因的 pBluescript II KS(−) 载体的 SpeI 和 NotI 位点(见补充材料Figure S2)。该质粒用于将丁酸途径基因整合至染色体上的 pta 启动子区域(见补充材料Figure S2)。
杨氏梭菌 Cre-lox 系统的构建
loxP 盒子构建如下:寡核苷酸 loxP1-T 和 loxP1-B(见补充材料表 S1)经磷酸化、退火后,克隆至 pNEB193 质粒(New England Biolabs)的 EcoRI 位点。获得正确方向 loxP1 序列的质粒后,再将磷酸化并退火的 loxP2-T 和 loxP2-B 寡核苷酸克隆至其 HindIII 位点,获得含正确方向 loxP2 的质粒用于后续操作。 catP 基因以 pMTL82151为模板、使用Table S1 引物进行 PCR 扩增,产物克隆至 pCR-Blunt II-TOPO。
随后,含 catP 的 BglII–SacII 片段被插入至含 loxP1 和 loxP2 的 pNEB 载体的 BglII 和 SacII 位点。接着,ermC 基因以 pCL1为模板扩增,产物克隆后,其 SphI–HindIII 片段被插入至含 loxP1、loxP2 和 catP 的 pNEB 载体的 SphI 和 HindIII 位点(见补充材料Figure S4)。 Cre 重组酶基因经密码子优化以适配梭菌表达,由 GenScript 公司合成(见补充材料Figure S5)。含 cre 的 KpnI–BamHI 片段被克隆至表达载体 pJKe-p 的相应位点。
pJKe-p 的构建过程如下:首先合成经梭菌密码子优化的卡那霉素抗性基因(kan,GenScript,见补充材料Figure S6),并与来自 pQexp 载体的 ermB 推定启动子(PermB)融合。PermB-kan 通过 PCR 扩增(引物见Table S1),克隆至 pCR-Blunt II-TOPO;其 ClaI–HpaI 片段用于替换 pJIR750ai(Sigma)中含 catP 的 ClaI–HpaI 区域。最后,将 pta 启动子插入至所得质粒 pJKe 的 EcoRI–KpnI 位点,构建出 pJKe-p。
pta 基因失活及丁酸途径基因整合(菌株 B4)
将前述含全部丁酸途径基因(thl、crt、bcd、etfB、etfA、hbd、ptb、buk)的 KpnI–SalI 片段,克隆至含 loxP1、loxP2、catP 和 ermC 的 pNEB 载体的 KpnI–SalI 位点。pta 编码序列内部片段(pta-int)通过 PCR 扩增(引物见Table S1),克隆至 pCR-Blunt II-TOPO;其 SpeI–KpnI 片段被插入至上述 pNEB 载体的 SpeI 和 KpnI 位点(见补充材料Figure S4)。
所得质粒用于将丁酸途径基因整合至染色体 pta 编码区内部,从而实现 pta 基因的敲除(见补充材料Figure S4)。
染色体整合完成后,通过 Cre 重组酶切除载体骨架及 catP 基因(见补充材料Figure S4 和 S7)。
电转化后,在含红霉素的培养基中复苏培养,随后加入卡那霉素至终浓度 20 µg/mL,继续过夜培养以促进 Cre 介导的 loxP 位点间重组。
复苏培养物随后在含红霉素和卡那霉素的平板上正常涂布。通过 PCR 验证载体骨架和 catP 的缺失以及丁酸基因的存在(见补充材料Figure S7)。
adhE1 基因失活(菌株 B5)
通过单交换同源重组在 adhE1 编码区内部实现基因敲除(见补充材料Figure S8)。adhE1 内部片段(adhE1-int)经 PCR 扩增(引物见Table S1),克隆至 pCR-Blunt II-TOPO;
其 SpeI–KpnI 片段被插入至含 catP 的 pNEB 载体的 SpeI 和 KpnI 位点。所得质粒用于在菌株 B4(其 pta 已失活)染色体上敲除 adhE1。
ctf 基因失活(菌株 B6)
ctf 基因(Clju_c39430)的敲除方法同 adhE1(见补充材料Figure S8)。ctf 内部片段(ctf-int)经 PCR 扩增(引物见Table S1),克隆后,其 SpeI–KpnI 片段被插入至含 catP 的 pNEB 载体。
所得质粒用于在菌株 B4 染色体上敲除 ctf。
蛋白质组学分析
野生型及 B1 菌株在果糖培养条件下的蛋白表达谱由马萨诸塞大学医学院蛋白质组学与质谱平台进行分析。
对数生长期的细胞被收集,每份蛋白样品(5 µg)进行 SDS-PAGE 电泳。切取凝胶条带,充分洗涤后用胰蛋白酶消化。每份消化样品以纳米液相色谱–串联质谱(nano-LC-MS/MS)进行三次重复分析。
反转录定量 PCR(qRT-PCR)
F使用 RiboPure-Bacteria 试剂盒(Life Technologies)按说明书从果糖培养的 B1 菌株中提取总 RNA。以随机九聚体为引物,使用 Enhanced Avian RT First Strand Synthesis 试剂盒(Sigma)按说明书合成 cDNA。PCR 使用Table S1 所列引物。
Western blot 分析
通过超声破碎法制备野生型、B1 和 B2 菌株(果糖培养)的细胞裂解液。样品经 SDS-PAGE 电泳后,进行 Western blot 分析。所用抗体针对 Crt 蛋白第 67–80 位氨基酸序列(DISEMKEMNTIERG)。该多肽及抗体均由 GenScript 公司制备。
分析方法
细胞生长通过测定 600 nm 处光密度(OD₆₀₀)进行监测。乙酸和丁酸采用高效液相色谱法(HPLC)测定,乙醇采用气相色谱法(GC)测定。
补充材料
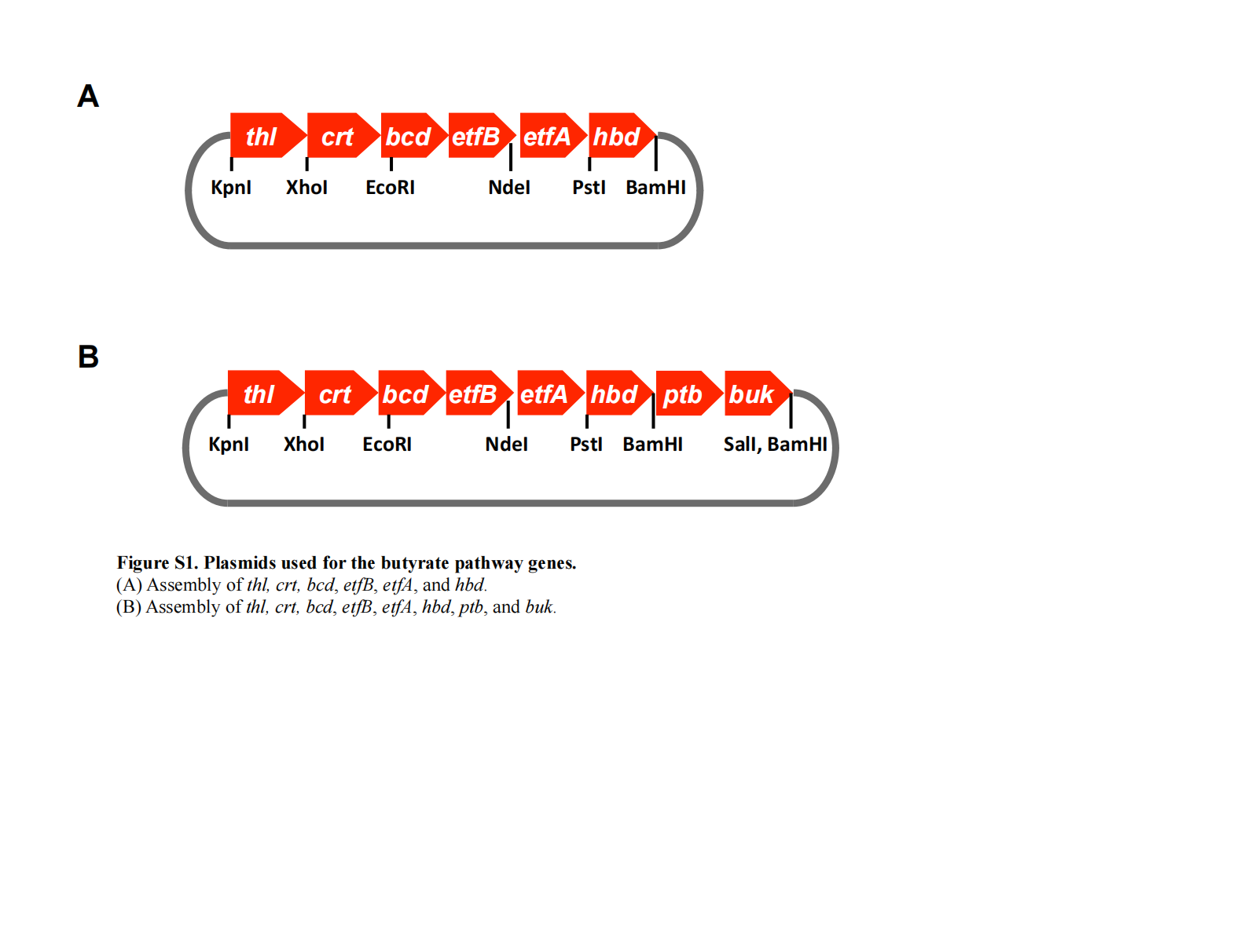
用于丁酸合成途径基因的质粒构建
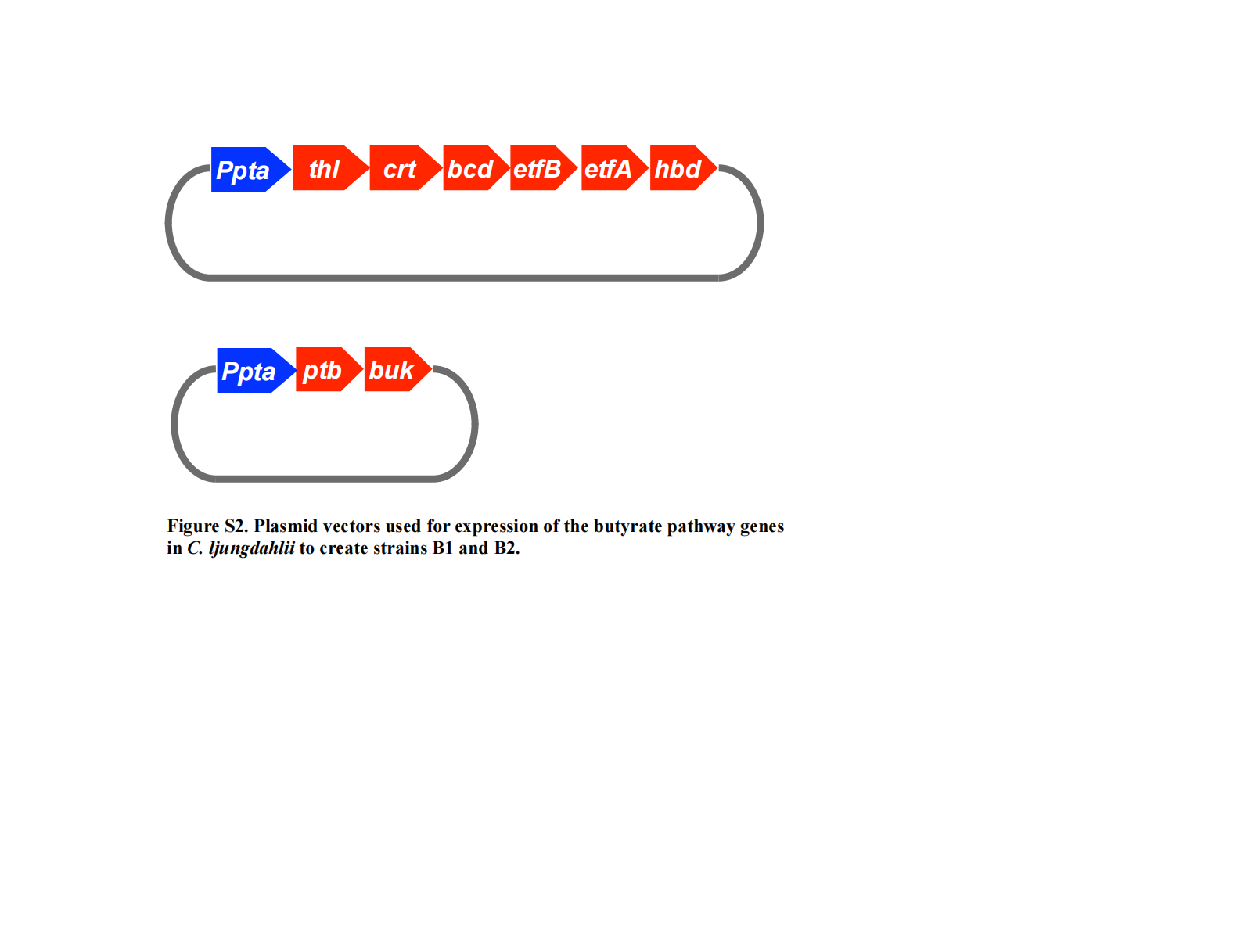
用于在杨氏梭菌(C. ljungdahlii)中表达丁酸合成途径基因,以构建菌株 B1 和 B2 的质粒载体
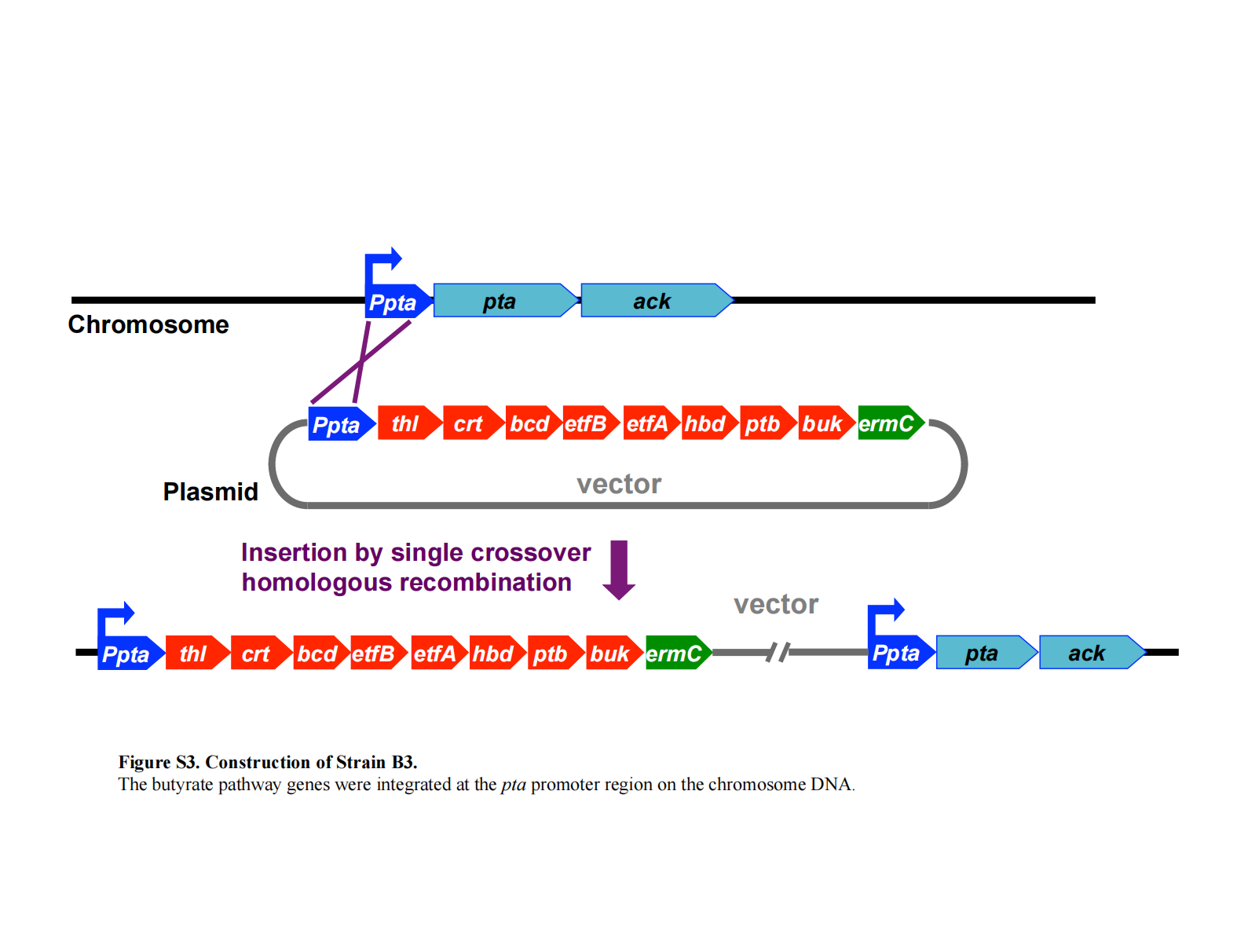
菌株 B3 的构建示意图
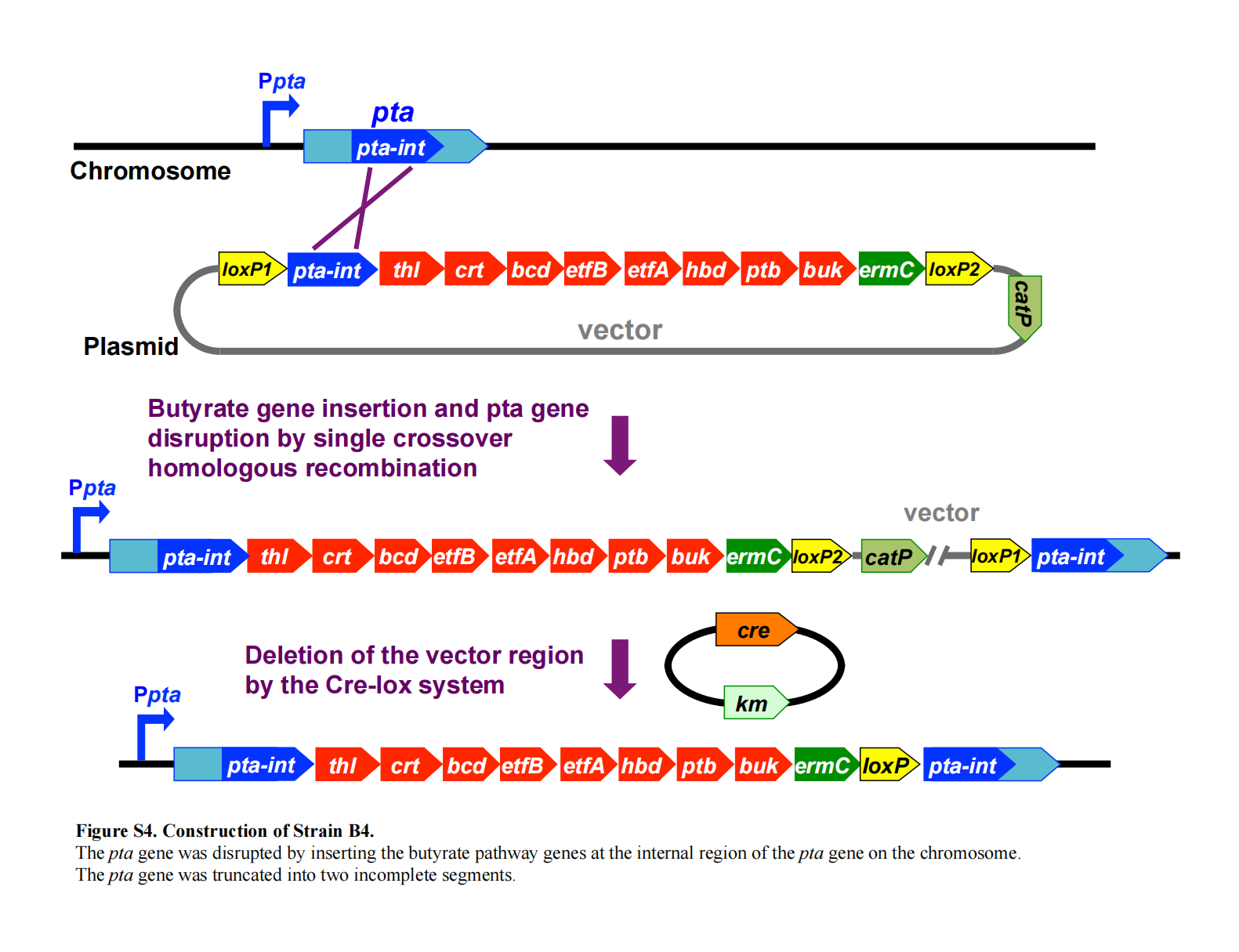
菌株 B4 的构建示意图

合成的 PermB-kan 基因序列
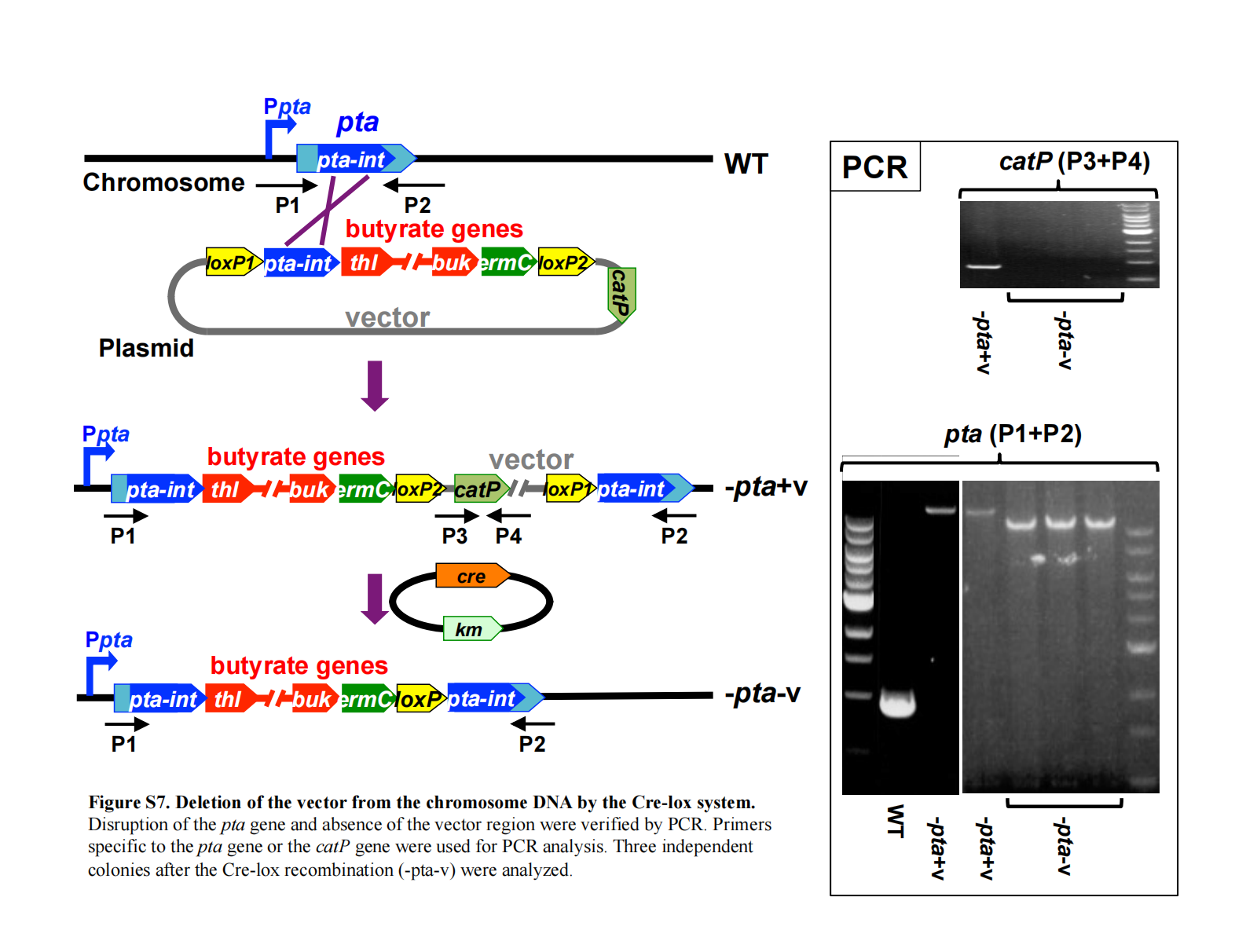
利用 Cre-lox 系统从染色体 DNA 中删除载体骨架
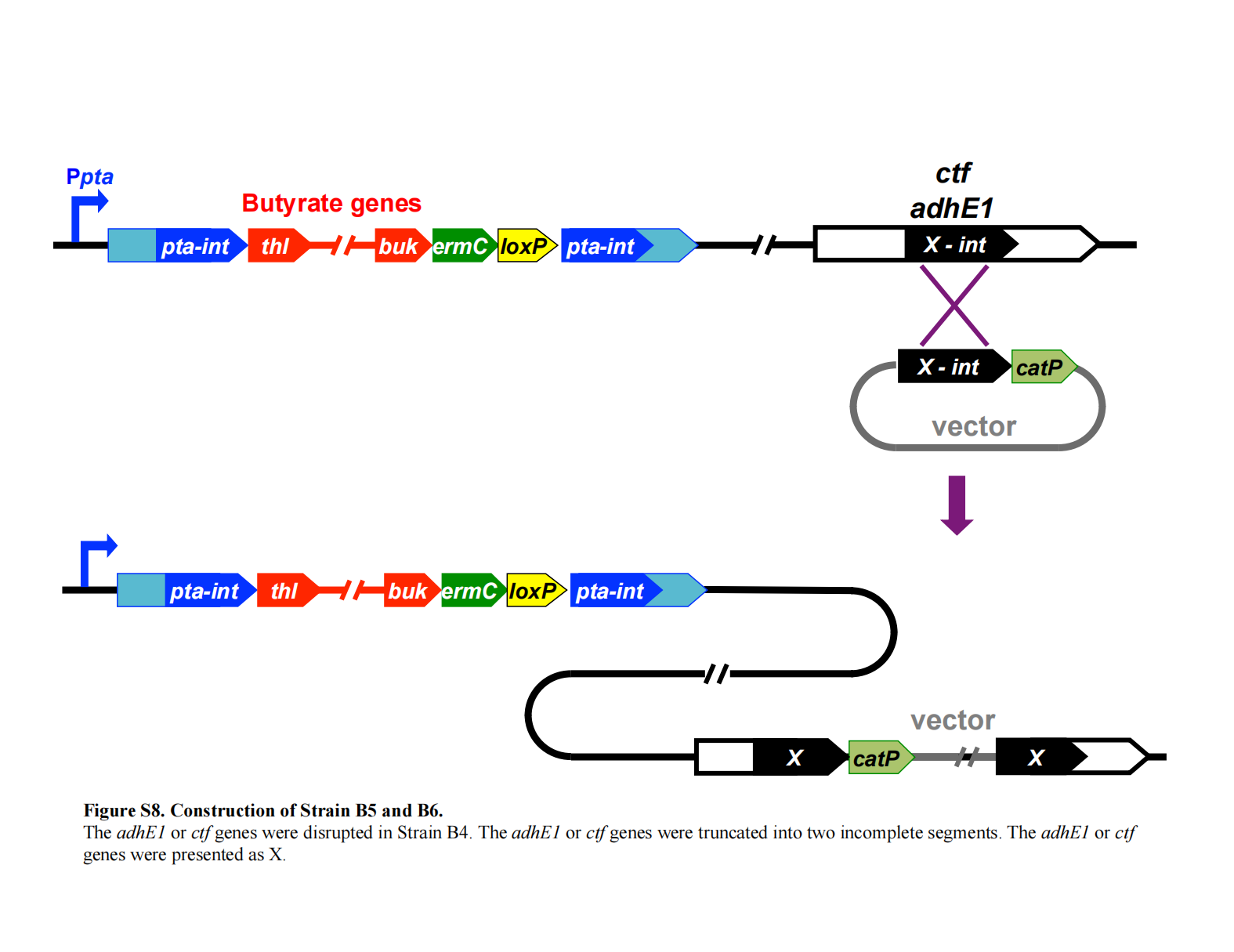
菌株 B5 和 B6 的构建示意图


研究中所用引物列表
参考文献
1.Bengelsdorf FR, Straub M, Dürre P. 2013. Bacterial synthesis gas (syngas) fermentation. Environ. Technol. 34:1639–1651. 10.1080/09593330.2013.827747
2.Daniell J, Kopke M, Simpson SD. 2012. Commercial biomass syngas fermentation. Energies 5:5372–5417. 10.3390/en5125372
3.Henstra AM, Sipma J, Rinzema A, Stams AJ. 2007. Microbiology of synthesis gas fermentation for biofuel production. Curr. Opin. Biotechnol. 18:200–206. 10.1016/j.copbio.2007.03.008
4.Lovley DR, Nevin KP. 2011. A shift in the current: new applications and concepts for microbe-electrode electron exchange. Curr. Opin. Biotechnol. 22:441–448. 10.1016/j.copbio.2011.01.009
相关产品
HZB414856:杨氏梭菌DSM 13528 | Clostridium ljungdahlii
敬请关注灰藻生物,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2026-1-29
编制人:大刘
审稿人:小藻
