乳制品微生物指标检测的最新发展趋势
来源:武汉市灰藻生物科技有限公司 浏览量:7 发布时间:2026-01-30 15:41:16
一、摘要
牛奶及乳制品,是常见且广泛消费的食品,牛奶易通过内源性(endo-)和外源性(exogenous)途径,被致病微生物污染。
本文介绍了,牛奶中的微生物群落(microflora),及其被致病微生物污染的途径,并总结了用于监测微生物指标的新兴方法,为行业相关专业人员提供参考。
二、引言
牛奶是哺乳动物乳腺分泌的一种生物液体,主要用于哺育幼崽,在其生命初期提供免疫保护。牛奶营养均衡,同时具备免疫学和抗菌特性。
然而,牛奶也为微生物的繁殖,提供了有利环境。尽管人们对大多数微生物,已有深入了解,但技术微生物学仍在不断发展,这主要受研究方法、微生物遗传学及系统分类学进步的推动。
当前,特殊微生物学(special microbiology)的一个发展趋势,是改进监控生鲜乳及乳制品安全性的微生物检测方法与设备。
因此,新的取样与分析方法不断涌现,同时原料乳处理、设备清洗与消毒工艺也在持续优化。然而,这也可能导致细菌对温度、抗生素及消毒剂产生抗性,出现更具侵袭性的菌株(aggressive strains)。
由此,对微生物指标的要求日益严格且复杂化,各类标准建议纷繁混乱,亟需对国内外标准进行协调与统一。
普遍评估方法:
在固体/液体培养基上,接种培养微生物(microbiological inoculation),或通过生物学分离方法,辅以血清学确认(serological confirmation)(如GOST、欧盟标准)。这些方法耗时长,依赖实验人员熟练度。
相比之下,基于化学、分子生物学方法,以及各类传感设备(sensor devices)的现代检测手段,已成为的重要发展方向。
本综述聚焦于,可能存在于生鲜乳或乳制品中的微生物种类,汇总了最新的微生物识别与定量技术,这些技术在乳品工厂中具有广阔的应用前景。
三、牛奶的微生物组成
牛奶的主要成分包括脂肪、蛋白质(如酪蛋白胶束 casein micelles 和 乳清蛋白 whey proteins),它们在含有其他有机与无机成分(如矿物质、维生素、酶等)的水相中形成胶体分散体系。这些成分共同赋予牛奶一定的抑菌(bactericidal)特性。
由于水分含量高,且富含碳源与能源(如乳糖、蛋白质、非蛋白含氮物质、脂肪、无机盐等),牛奶成为多种微生物生长的理想培养基。
生鲜乳中可存在不同分类群的微生物,包括酵母(yeasts)、霉菌(molds)、病毒(如噬菌体 bacteriophages,可灭活有益发酵菌 starter microflora)以及细菌。
牛奶中细菌总量受多种因素影响,其中最主要的是挤奶、储存过程中的卫生条件以及运输与储存温度。
四、牛奶细菌污染的来源及防控措施
牛奶污染源可分为内源性(endogenous/internal)和外源性(exogenous/external)两类(图1)。
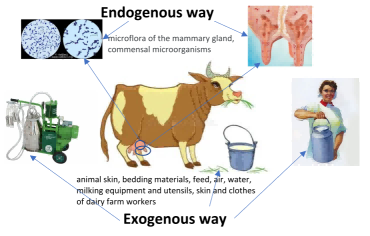
图1.牛奶污染的来源
新鲜生鲜乳并非无菌,通常每立方厘米含有数百至数千个细菌。这些微生物主要直接来自乳腺乳头管(teat canal),构成牛奶的正常菌群(normal bacterial flora),其中多为附生于植物表面的表生微生物(epiphyte microorganisms),对人体健康无害,但可导致牛奶快速腐败。
生鲜乳正常菌群的主要代表为,腐生性(saprophytic)微生物,包括乳酸菌(lactic acid bacteria)和球菌(cocci),如乳酸乳球菌(Lactococcus lactis)、乳脂乳球菌(L. cremoris)、嗜热链球菌(Streptococcus thermophilus)。此外,植物表生菌群中的植物乳杆菌(Lactobacillus plantarum)也是乳腺共生菌(udder commensals)之一。这些微生物的存在被视为牛奶分泌性污染(secretory contamination)的标志。
外源性污染源包括动物皮肤、垫料、饲料、空气、水、挤奶设备与器具,以及牧场工作人员的皮肤与衣物。这种在泌乳后发生的污染称为分泌后污染(post-secretory contamination),其污染菌群通常包含嗜冷菌(psychrophilic)、嗜温菌(mesophilic)和嗜热菌(thermophilic)。
挤奶过程中,乳头皮肤与乳杯之间形成的乳膜,以及皮肤上的粗细褶皱,为微生物生长创造了有利条件。稻草和干草等垫料可导致动物皮肤乃至牛奶被大肠杆菌(E. coli)、丁酸菌(butyric acid bacteria)、肠球菌(enterococci)、腐败芽孢菌(putrefactive spore-forming bacteria)、酵母、霉菌及乳酸菌等污染。新鲜青草富含乳酸菌,而粗饲料则更多含有好氧性腐败芽孢菌。饲料中还可能含有丙酸菌、醋酸菌、放线菌(actinomycetes)及酵母。若给奶牛饲喂酸败饲料、混入泥土的饲料或劣质青贮饲料,且动物卫生状况不佳,则易导致牛奶被丁酸菌等污染。
牧场空气中微生物群主要由微球菌属(Micrococcus spp.)、八叠球菌属(Sarcina spp.)、酵母细胞及霉菌孢子组成。符合《SanPiN 2.1.4.1074-01》标准的清洗用水所含微生物极少。挤奶机与储奶罐是牛奶被嗜冷菌(尤其是假单胞菌 Pseudomonas)污染的主要来源。在清洗消毒不彻底的设备表面,嗜冷微生物可在乳水介质中大量繁殖。此外,乳酸菌、大肠杆菌、微球菌、腐败菌等也易在未充分清洗干燥的设备中滋生。工作人员的皮肤与衣物也可能成为牛奶被大肠杆菌、葡萄球菌属(Staphylococcus spp.)、链球菌属(Streptococcus spp.)等病原体污染的来源。
五、导致牛奶及乳制品腐败的微生物
腐败菌(主要是蛋白分解菌 proteolytic bacteria)通过分解蛋白质,引起乳制品出现苦味、胨化(peptonization)、质地改变,以及腐臭、霉味、哈喇味、果香、酵母味、酸味等异味。生鲜乳中可能含有以下腐败菌:
- 好氧芽孢菌:
如丁酸梭菌(Bacillus butylicum)、嗜热乳杆菌(B. calidolactis)、蜡样芽孢杆菌(B. cereus)、环状芽孢杆菌(B. circulans)、蕈状芽孢杆菌(B. cereus var. mycoides)、侧孢芽孢杆菌(B. laterosporus)、巨大芽孢杆菌(B. megaterium)、枯草芽孢杆菌(B. subtilis)等;
- 厌氧菌:
如丁酸梭菌(Clostridium butyricum)、酪丁酸梭菌(Cl. tyrobutyricum)、产气荚膜梭菌(Cl. perfringens)、生孢梭菌(Cl. sporogenes);
- 产色素菌:
如荧光假单胞菌(Pseudomonas fluorescens)、铜绿假单胞菌(Ps. aeruginosa)、粘质沙雷氏菌(Serratia marcescens);
- 兼性厌氧非芽孢菌:
如普通变形杆菌(Proteus vulgaris)、大肠杆菌(E. coli)(Wang et al., 2015)(见表1)。
表1 原奶中外来微生物的主要种类
| 微生物名称 | 污染牛奶的方式 | 用于定性与定量分析的检测方法(根据GOST或欧盟标准) | 规定参数(根据GOST或欧盟标准) | 对牛奶及乳制品造成的缺陷 |
|---|---|---|---|---|
| 产芽孢好氧芽孢杆菌(Bacillus butyricus, B. calidolactis, B. cereus, B. circulans, B. cereus var. mycoides, B. laterosporus, B. megatherium, B. mesentericus, B. polyxina, B. pumilis, B. patrifaciens, B. subtilis, B. thermoliquefaciens, B. stearothermophilus) | 外源性(挤奶、运输和储存过程中卫生条件差) | 接种琼脂或液体培养基(GOST 32901-2014) | 不超过5×10⁵(QMAFAnM评估) | 苦味;胨化;质地变化;异味(如腐臭/酸败气味、霉味/果味/酵母味)、丁酸发酵 |
| 产芽孢厌氧芽孢杆菌(Clostridium butyricum, Cl. tyrobutyricum, Cl. perfringens, Cl. sporogenes) | 外源性(挤奶、运输和储存过程中卫生条件差) | 接种琼脂或液体培养基(GOST 32901-2014) | 未定义 | 同上 |
| 产色细菌(Pseudomonas fluorescens, Ps. aeruginosa, Serratia marcescens) | 外源性(挤奶、运输和储存过程中卫生条件差) | 接种琼脂或液体培养基(GOST 32901-2014) | 未定义 | 同上 |
| 兼性厌氧无芽孢杆菌(Proteus vulgaris, Escherichia coli) | 外源性(挤奶、运输和储存过程中卫生条件差) | 接种琼脂或液体培养基(GOST 32901-2014) | 未定义 | 同上 |
| 热耐受菌属(Micrococcus, Sarcina, Microbacterium, Streptococcus 和热耐受双球菌 Enterococcus faecalis 生物型 liquefaciens) | 内源性(来自动物体内的正常菌群) | 接种琼脂或液体培养基(GOST 32901-2014) | 未定义 | 在生产奶油奶酪、酸奶油、凝乳奶时产生强烈酸味,导致奶味不纯、口感粗糙、蛋白质提前凝固以及成品出现苦味 |
| 酵母和霉菌(Saccharomyces, Candida, Kluyveromyces, Geotrichum, Torulopsis, Rhodotorula, Pichia, Debaromyces, Sporabolomyces) | 外源性(与霉菌污染的食物接触) | 接种琼脂培养基(GOST 33566-2015) | 未定义 | 黄油脂肪变质,产生腐臭味或苦味 |
| 金黄色葡萄球菌属细菌和链球菌属致病菌 | 外源性(患有乳房炎的动物、有脓疱性皮肤病或扁桃体炎的人) | 接种选择性增菌培养基(GOST 30347-2016) | 未定义 | 牛奶的凝固和胨化 |
| 单核细胞增生李斯特菌(Listeria monocytogenes) | 外源性(患者和带菌者) | 接种选择性增菌培养基(GOST 32031-2022) | 未定义 | 不引起缺陷 |
| 沙门氏菌(Salmonella) | 外源性(感染的农场动物和鸟类) | 接种选择性增菌培养基(GOST ISO 6785-2015) | 25 cm³ 中不允许检出 | 不引起缺陷 |
巴氏杀菌乳中的微生物主要包括,耐热菌,如微球菌属(Micrococcus)、八叠球菌属(Sarcina)、微杆菌属(Microbacterium)、链球菌属(Streptococcus)。
它们的代谢活动可导致干酪、酸奶油、凝乳等产品在生产过程中过度产酸、拉丝(ropiness)或产生不洁异味。粪肠球菌(Enterococcus faecalis)具有耐热性,可引起牛奶过早凝固并产生苦味缺陷。
在发酵乳制品生产中,发酵剂菌群(starter microflora)活性下降最常见的原因是生鲜乳或巴氏乳中存在噬菌体(bacteriophages)。这会导致最终凝乳酸度不足、凝乳时间延长及产品风味不明显。
六、生鲜乳及乳制品中的致病微生物
许多食源性病原体存在于土壤、水体、动物及植物中,可通过原料或与人员、设备接触进入乳制品。一旦摄入,这些微生物可引发食物中毒或食源性疾病,严重危害人体健康。
葡萄球菌属(Staphylococcus) 可存在于患乳腺炎(mastitis)奶牛的乳汁中,或由携带葡萄球菌感染的人员引入。挤奶后若未及时冷却,可促进葡萄球菌繁殖并积累肠毒素A(enterotoxin A)等代谢产物。根据俄罗斯联邦国家标准(GOST 30347-2016;TR CU 033/2013),所有乳制品中均对金黄色葡萄球菌(S. aureus)的致病菌株有明确限量要求。尽管葡萄球菌在酸性环境中易死亡,但其产生的毒素浓度在产品中保持不变。
链球菌属(Streptococcus) 病原体可引起乳腺炎(如无乳链球菌 Str. agalactiae、类马链球菌 Str. dysagalactiae)、化脓性炎症、败血症(如化脓性链球菌 Str. pyogenes),以及急性或慢性感染(如马链球菌 Str. equi、肺炎链球菌 Str. pneumoniae)。这些微生物可通过患乳腺炎或败血症的动物,或患有化脓性皮肤病的人员污染乳品。链球菌产生的毒素类型与葡萄球菌类似,但在煮沸时会迅速失活,因此巴氏杀菌可有效灭活此类病原体。
牛奶中体细胞(somatic cells)含量必须严格监控,严禁加工乳腺炎乳。同时应建立巴氏杀菌效果的监控机制。工作人员的健康状况至关重要,因其可能成为乳制品被致病微生物污染的真实来源。
某些霉菌可产生有毒代谢物,如黄曲霉毒素(aflatoxins)、赭曲霉毒素(ochratoxins)(由曲霉属 Aspergillus 产生),冰岛霉素(icelandin)、红毒素(rubrotoxin)(由青霉属 Penicillium 产生)及有毒有机酸。俄罗斯联邦技术法规(GOST 33566-2015;TR CU 033/2013)对所有乳制品中的酵母、霉菌及黄曲霉毒素M(aflatoxin M)含量,以及干乳制品和婴幼儿食品中的黄曲霉毒素B(aflatoxin B)和赭曲霉毒素均有明确规定。
肠炎沙门氏菌(Salmonella enteritidis) 污染主要源于患病动物,或因乳品加工、储存、运输不当所致。若初始浓度不超过每立方厘米 3×10¹² 个细胞,常规巴氏杀菌足以灭活沙门氏菌(Salmonella spp.)。根据俄联邦标准(GOST ISO 6785-2015;TR CU 033/2013),成品乳制品中不得检出沙门氏菌(25 g样品中)。
埃希氏菌属(Escherichia) 在特定条件下可转化为致病菌,引发人体多种病理反应。如大肠杆菌(E. coli)、弗格森埃希菌(E. fergusonii)、赫尔曼埃希菌(E. hermannii)、脆弱埃希菌(E. vulneris)和蜚蠊埃希菌(E. blattae)均可分泌耐热内毒素(thermostable endotoxin),该毒素可耐受90–100°C高温。尽管大肠菌群(E. coli group)通常在60°C以上热处理中死亡,但法规仍强制要求在成品乳制品及其生产过程中检测其是否存在(GOST 32901-2014;GOST 31449-2013;GOST R 52054-2003)。
乳制品中常见的机会致病菌包括:
- 蜡样芽孢杆菌(B. cereus):因耐受巴氏杀菌,常见于干乳制品;
- 普通变形杆菌(Proteus vulgaris):存在于高蛋白乳制品中;
- 产气荚膜梭菌(Cl. perfringens):可导致牛奶产生凝块与泡沫。
这些细菌在特定人群和条件下可致病,但若巴氏杀菌操作规范,P. vulgaris 与 Cl. perfringens 均可被有效灭活。
若农场及乳品加工环节卫生条件不达标,生鲜乳或成品可能被志贺氏菌(Shigella sonnei, S. flexneri)、单核细胞增生李斯特菌(Listeria monocytogenes)、阪崎肠杆菌(Enterobacter sakazakii)、霍乱弧菌(Vibrio cholerae)等污染。
综上所述,牛奶微生物组成极为复杂。其中,梭菌属(Clostridium)、葡萄球菌属(Staphylococcus)、沙门氏菌属(Salmonella)、李斯特菌属(Listeria)和埃希氏菌属(Escherichia)是最危险且最常见的外来菌群(extraneous microflora),因此对其检测必须兼具快速性与高灵敏度。
七、食品中微生物检测的基本原理
为保障食品安全与品质,常规需对牛奶进行致病菌与腐败菌检测。然而,在微生物呈指数级繁殖前难以检出。微生物的检测/鉴定可通过以下方式实现:
- 直接法:检测微生物细胞、胞内化合物或细胞壁组分;
- 间接法:检测与细菌生长代谢相关的指标,如pH变化、电导率/阻抗、耗氧量、二氧化碳生成量、挥发性与非挥发性有机物组成等。
不同微生物分泌的代谢物组合具有特异性,常被用于开发间接检测方法。本文补充材料列出了牛奶及乳制品中最常见微生物的主要代谢产物。
下文将综述近年来开发的牛奶及乳制品微生物检测方法与技术。
八、牛奶及乳制品中微生物的检测方法
8.1 基于微生物细胞、胞内成分及细胞壁组分的检测方法
传统方法仍以平板培养计数(plating and enumeration)为主。该法灵敏度高、成本低,可提供微生物数量与种类信息,但耗时长(24–72小时检出,一周以上鉴定病原体)(Wang and Salazar, 2016),无法满足乳品行业对病原体快速检测的需求。因此,加速检测与监控食源性病原体的方法正被积极开发。
8.2 ATP检测法
三磷酸腺苷(Adenosine triphosphate, ATP)是所有生命系统生化反应的通用能量来源,亦参与核酸合成及多种酶活性调控。样品中ATP浓度与活菌数量直接相关。目前最广泛应用的快速检测法为ATP生物发光法(ATP bioluminescence)(Poghossian et al., 2019)。
该法基于萤光素(luciferin)与萤光素酶(luciferase)在ATP存在下的酶促反应发光。在Mg²⁺存在下,萤光素酶催化D-萤光素转化为氧化萤光素(oxyluciferin),同时ATP水解为AMP并释放焦磷酸(PPi)及可见光子。通过发光仪(luminometer)测得的光强与ATP浓度成正比(线性范围:10 fM–1 μM)。
该法优势在于快速与高灵敏度(检测限1 pg ATP ≈ 10³个微生物细胞)。主要缺点是非微生物来源或胞外ATP会产生背景信号,导致污染水平被高估。因此,总ATP并不总与活菌数相关,需通过样品前处理去除背景ATP。此外,不同微生物细胞的ATP含量因种类、大小及能量状态而异。
在复杂食品基质(如乳制品)中,当微生物含量 ≥10⁴ CFU/g 时,该法可测定总菌数。通过富集微生物细胞(如免疫磁分离结合热处理技术),可将检测限降至3.1×10¹–10⁶ CFU/cm³,检测时间缩短至30分钟内。
8.3 核酸扩增法
分子方法因高特异性与高灵敏度,在食品质量控制中日益重要,可克服传统微生物学方法的局限,数小时内即可鉴定特定微生物、区分近缘种,甚至检测转基因成分(GMOs)。
聚合酶链式反应(Polymerase Chain Reaction, PCR)
PCR无需培养即可扩增目标微生物DNA特定区域,具有特异性强、灵敏度高、数小时内出结果等优点。主要缺点是无法区分活/死细胞,易导致假阳性;且微量外源DNA污染即可造成误判。
实时荧光定量PCR(real-time PCR)在未富集条件下对食品中病原体的定量限约为10³–10⁴ CFU/cm³(g)。目前正致力于提高对特定病原体的灵敏度及多重检测能力。在乳品工业中,该法对低浓度高危病原体(如单核细胞增生李斯特菌 Listeria monocytogenes、金黄色葡萄球菌 Staphylococcus aureus、产气荚膜梭菌 Clostridium perfringens)的检测尤为重要。
- 产气荚膜梭菌检测:常以α-毒素与肠毒素基因为靶标。基于磷脂酶C基因(phospholipase C gene)的实时PCR法,在25 cm³人工污染牛奶中可78%概率检出300个孢子,50%概率检出30个孢子。
- 金黄色葡萄球菌检测:采用带正电荷的聚赖氨酸包被磁珠通过静电吸附富集细菌,检测限达1.8×10² CFU/cm³,优于常规PCR。大肠杆菌检测亦获类似结果。
鉴于单核细胞增生李斯特菌所致食源性感染的高发病率与死亡率,其快速检测方法正被大力开发。多重PCR(multiplex PCR)可同步检测多种病原体。例如,已开发出可同时检测 L. monocytogenes、Bacillus cereus 和 Campylobacter jejuni 的多重PCR法。
其他核酸扩增技术
环介导等温扩增(Loop-mediated Isothermal Amplification, LAMP) 是传统PCR的替代方案,可在单一温度下高效扩增目标DNA,无需昂贵热循环仪及DNA纯化试剂盒。该法已用于食品中金黄色葡萄球菌检测,在人工污染牛奶中检测限达10 CFU/cm³,分析时间仅30分钟。
LAMP亦成功用于生鲜乳及乳制品中单核细胞增生李斯特菌检测。研究比较了LAMP与重组酶聚合酶扩增(Recombinase Polymerase Amplification, RPA)对多种食品中 L. monocytogenes 的快速定量效果。两种方法与实时PCR及参考培养法结果高度一致,检测限 <10 CFU/25 g。后续研究进一步开发了含内参的多重实时RPA法,对乳制品中 L. monocytogenes 的检测限 <10 CFU/25 g,分析时间24–48小时,灵敏度与特异性媲美ISO 11290参考法。
最新进展包括结合免疫磁分离(immunomagnetic separation)与叠氮溴化丙锭(propidium monoazide, PMA)的LAMP法——PMA可阻断死细胞DNA扩增,从而特异性检测活菌,检测限达2.7 CFU/25 g。
8.4 仪器传感技术
食品质量控制与细菌检测的新兴趋势是开发基于传感器技术的快速病原体与腐败菌检测方法。按换能器类型,传感器可分为电化学(电位法、安培法、电导法、阻抗谱)、光学、声学、压电、质量敏感型等。按识别机制,又可分为化学传感器与生物传感器(biosensors)。
针对微生物细胞或细胞壁组分的传感器多采用生化识别机制。新型传感器则利用磁弹性合金共振或纳米颗粒表面等离子共振(surface plasmon resonance)识别完整细胞。例如,细菌黏附于磁弹性合金表面会增加传感器质量,导致其在交变磁场中振荡的特征共振频率发生变化。一种基于硅烷醇前驱体杂化膜的磁弹性合金传感器可非选择性检测人工污染牛奶中的大肠杆菌与金黄色葡萄球菌(浓度范围10³–10⁸ CFU/cm³)。
另有研究提出一种免扩增可视化检测法:利用捕获于磁性微球表面的多重金纳米颗粒(AuNPs)增强等离子信号,可快速高敏检测乳腺炎奶牛乳汁中分离的大肠杆菌特异性DNA(图2)。该法在模板DNA制备后1–1.5小时内完成,肉眼即可判读,最低可检10² CFU/μl微生物负载或1 pg细菌DNA。
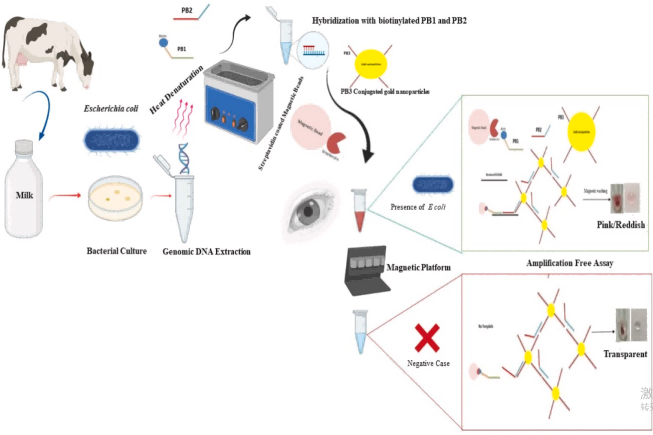
图2.用于检测牛乳中大肠杆菌(Escherichia coli)的免扩增可视化检测方法的示意图
生物传感器(Biosensors)
生物传感器广泛用于乳品中病原微生物检测,其原理是将微生物代谢物与传感器敏感层间的生物响应转化为物理信号,从而直接或间接估算微生物存在及浓度。乳品分析中最常用的是质量敏感型、光学及电化学生物传感器,或其组合。敏感涂层常采用抗菌肽(antimicrobial peptides)、纳米材料、核酸、细胞器、适配体(aptamers)、酶、抗体等,以增强信号与灵敏度。
主要优势包括分析快速、操作简便、成本相对较低。例如:
- 基于压电谐振器与罗丹明标记抗体的免疫磁装置可用于检测弯曲杆菌(Campylobacter spp.)和单核细胞增生李斯特菌,后者检测限低至3个细菌/牛奶样本(Bonaiuto et al., 2018)。
- 一种新型“抗生素-病原体-抗体”三明治模型生物传感器采用胶体金颗粒,以万古霉素(vancomycin)为抗生素识别层,对 L. monocytogenes 和 S. aureus 的目视检测限分别达10³ 和 10⁵ CFU/cm³(Huang, 2021)。
- 基于金黄色葡萄球菌蛋白A与碳点标记荧光微球的生物传感器可用于检测牛奶中大肠杆菌(图3),30分钟内可检 >10² CFU/cm³,经富集后检测限 <10 CFU/cm³。利用磁螺菌(Magnetospirillum sp. RJS1)提取的磁小体(magnetosomes)结合抗李斯特溶血素抗体构建的传感器,对李斯特菌属(Listeria ssp.)特异性高,检测限达10 CFU/cm³,且成本更低。
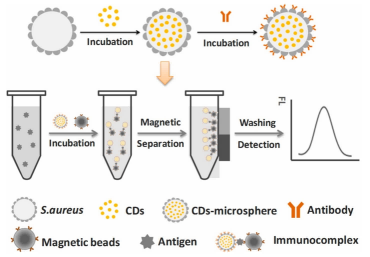
- 图3.基于细胞的碳点微球(CDs-microspheres)的构建策略及其作为荧光免疫传感器用于病原体检测的应用。
抗菌肽亦被用于构建食源性病原体生物传感器,可提升稳定性并简化储存要求。例如:
- 基于Leucocin A肽与电化学阻抗显微镜的生物传感器可在50分钟内检测牛奶中李斯特菌属(检测限2×10⁵ CFU/cm³);
- 以Nisin肽为敏感层的传感器可在30分钟内检测牛奶中沙门氏菌、大肠杆菌O157:H7、无害李斯特菌(L. innocua),检测限10–10⁴ CFU/cm³。
为增强检测信号,肽包被纳米颗粒被用作生物传感器敏感层。纳米颗粒的稳定性与理化性能结合肽的高选择性,可显著提升传感器分析性能。
针对牛奶中大肠杆菌的快速可靠检测,一种基于适配体与MEG-Cl连接剂的超高频电磁压电声学传感器被提出,检测限达8 CFU/cm³,低于法规限值。生物传感器的主要局限在于使用寿命较短及对储存与使用条件要求苛刻。
九、基于微生物代谢产物及牛奶理化性质变化的检测方法
微生物代谢产生大量化学物质(初级与次级代谢物)。其酶可分解牛奶中的蛋白质、脂肪与碳水化合物,同时分泌多种挥发性有机物(volatile organic compounds, VOCs),即挥发性生物标志物(volatile biomarkers)。部分代谢物依赖培养基,部分则具有菌种特异性。微生物生长导致牛奶pH、离子组成、电导率及挥发性/非挥发性代谢物组成发生变化。以下介绍几种关联细菌代谢的牛奶理化参数检测新技术。
电化学传感器
牛奶初筛常采用pH测量与阻抗谱(impedance spectroscopy)。细菌生长副产乳酸等酸类,导致pH下降。但由于牛奶缓冲能力强,仅当产酸量显著时pH才明显变化,故pH仅能作为简单质量或腐败指标。
阻抗传感器基于微生物生长及带电代谢物生成引起的电导率变化,或细菌黏附电极表面导致的界面阻抗变化。其局限在于需较高菌量(6.0–7.0 log₁₀ CFU/cm³)才能显著改变电学性质。该技术已用于牛奶细菌检测及生鲜/巴氏乳货架期评估。
电子鼻
气味是食品感官品质的关键参数。每种产品均有特征性VOC谱,形成独特气味。该特征谱可作为微生物腐败或病原体污染的指示器。
牛奶微生物腐败特征代谢物包括H₂S、NH₃、CO₂、H₂、H₂O₂、碳酸氢盐、乳酸、乙酸、双乙酰(diacetyl)、乙偶姻(acetoin)、乙醇、尿素等,可作为早期腐败标志物。
生鲜乳中病原体分泌多种挥发性化合物,如酮类(C2, C5, C7,含二酮、羟基酮)、醇类、醛类、酸类、酯类(C2–C8,含支链结构)。不同微生物酶系产生特异性挥发性代谢物组合,此原理被用于电子鼻检测与鉴定。
电子鼻由气体传感器阵列(通常为非特异性)与数据处理单元组成,可生成特征性“气味指纹(odor print)”。常用传感器包括金属氧化物半导体(SnO₂、TiO₂、WO₃、ZnO、ZrO₂)与导电聚合物薄膜,其电导率随气体吸附而变化。
电子鼻不仅用于预测牛奶保质期与检测微生物腐败,还可按品牌、类型、脂肪含量分类,并通过异味检测监控牛奶质量。基于10种金属氧化物半导体传感器的定量模型可高精度测定牛奶总菌数,适用于高、中、低菌量样本。
更具挑战性的是开发可区分腐败菌与病原体的电子鼻。研究表明,通过比对气体谱、菌量及挥发性代谢物质谱,气体传感器系统可基于挥发物类型与含量估算牛奶中多种细菌生长情况。一项研究利用电子鼻(16个金属氧化物半导体传感器)与电子舌(E-tongue)区分巴氏乳中大肠杆菌与其他肠杆菌科细菌(如肺炎克雷伯菌 Klebsiella pneumoniae、肠炎沙门氏菌 Salmonella enterica)。电子鼻识别大肠杆菌概率超90%,电子舌可检测10⁶ 至 10⁻² CFU/cm³浓度范围。
另有设备整合两个气体传感器与电导率测量模块,用于检测乳腺炎牛奶。MQ-135传感器(检测CO₂与NH₃)可77%准确率识别乳腺炎奶牛乳汁。表2简要描述了本文所述牛奶及乳制品致病微生物检测方法与技术。
表2.牛奶中致病性微生物检测方法的简要描述
| 检测方法 | 检测细菌 | 目标 | 测量特征 | 分析时间 | 检出限 | 参考文献 |
|---|---|---|---|---|---|---|
| 核酸扩增法 | 任意细菌 | 原料及食品产品的微生物质量控制 | 无需预富集的PCR | 12–24小时 | 10³–10⁴ CFU/cm³ | Wang 和 Salazar (2016) |
| Clostridium perfringens | 食品安全 | 实时PCR | - | 25 cm³ 中300个芽孢 | Hernández 等 (2017) | |
| Staphylococcus aureus,Escherichia coli | 食品安全 | 结合带正电荷磁性珠子(表面包覆聚-L-赖氨酸)的PCR | - | 1.8×10² CFU/cm³ | Deng 等 (2021) | |
| Staphylococcus aureus | 食品安全 | LAMP | 30分钟 | 10 CFU/cm³ | Srimongkol 等 (2020) | |
| Staphylococcus aureus | 食品安全 | SRCA(序列特异性扩增) | - | 5.6×10¹ CFU/cm³ | Yang 等 (2019) | |
| Listeria monocytogenes | 食品安全 | 实时PCR,设计特异性引物、杂交探针,DNA提取前进行4小时预培养 | - | 10–100 CFU/cm³ | Heo 等 (2014) | |
| Listeria monocytogenes,Salmonella spp.,Staphylococcus aureus and Escherichia coli | 食品安全 | 多重PCR | - | 每种病原体 <2.0×10² CFU/cm³ | Xu 等 (2016) | |
| Listeria monocytogenes | 食品安全 | 多重RPA(重组酶介导扩增) | 24–48小时 | <10 CFU/25 g | Garrido-Maestu 等 (2020) | |
| Listeria monocytogenes | 食品安全 | LAMP、RPA | - | <10 CFU/25 g | Garrido-Maestu 等 (2018) | |
| Listeria monocytogenes | 原料及食品产品的微生物质量控制 | LAMP、免疫磁分离,使用碘化丙啶(propidium monoazide),可阻断非活性细胞的DNA扩增 | - | 2.7 CFU/25 g | Roumani 等 (2021) | |
| 细胞及细胞组分识别传感器 | 任意细菌,例如 Escherichia coli、Staphylococcus aureus | 食品安全 | 由磁弹性合金制成的传感器,其上覆盖基于二氧化硅烷氧基的杂化薄膜 | - | 10³ CFU/cm³ | Beltrami 等 (2017) |
| Escherichia coli | 原料及食品产品的微生物质量控制 | 基于多金纳米颗粒(AuNPs)捕获在磁性微珠表面的免扩增可视化检测法 | 1–1.5小时 | 10² CFU/cm³ | Deb 等 (2022) | |
| 生物传感器 | Escherichia coli | 原料及食品产品的微生物质量控制 | 超高频率电磁压电声学传感器装置(EMPAS),适配体通过抗污染连接子MEG-C1共价结合至传感器表面 | - | 8 CFU/cm³ | Spagnolo 等 (2022) |
| Campylobacter、Listeria monocytogenes | - | 基于石英谐振器和罗丹明的免疫磁性器件,抗体与细菌结合 | - | 3个细菌 | Bonaiuto 等 (2018) | |
| Listeria monocytogenes、Staphylococcus aureus | 原料及食品产品的微生物质量控制 | 胶体金-万古霉素复合物,结合高灵敏度多克隆抗体 | - | 10⁵ 和 10³ CFU/cm³ | Huang (2021) | |
| Escherichia coli O157:H7 | 原料及食品产品的微生物质量控制 | 基于碳点(CDs)标记的微球的荧光免疫传感器,CDs由携带金黄色葡萄球菌细胞(表面含蛋白A)制备 | 30分钟 | 2.4×10² CFU/cm³ | Zhao 等 (2021) | |
| Staphylococcus aureus | 原料及食品产品的微生物质量控制 | 万古霉素功能化的金纳米簇(Van@Au NCs)与适配体链结合 | - | 1 CFU/cm³ | Wu 等 (2022) | |
| Listeria monocytogenes | 原料及食品产品的微生物质量控制 | 酶联免疫吸附法:从 Magnetospirillum sp. RJ51 提取的磁小体直接结合抗李斯特菌溶素抗体 | - | 10 CFU/cm³ | Sannigrahi 等 (2020) | |
| 多肽基传感器 | Listeria monocytogenes | 原料及食品产品的微生物质量控制 | 采用天然产生的Ia类细菌素(leucocin A)功能化的阻抗阵列传感器,在实时模式下运行 | - | 10³ CFU/cm³ | Etayash 等 (2014) |
| Listeria monocytogenes | 原料及食品产品的微生物质量控制 | 将 leucocin A 固定在玻璃表面,形成自组装单分子层(SAM)多肽。传感器暴露于污染样品后,与多肽结合的细菌被高荧光金纳米簇直接标记在玻璃表面 | 50分钟 | 2×10⁵ CFU/cm³ | Hossein-Nejad-Ariani 等 (2018) | |
| Salmonella spp.、Escherichia coli O157:H7、Listeria innocua | 原料及食品产品的微生物质量控制 | 基于金电极上尼辛(Nisin)分子的电化学阻抗光谱传感器 | 30分钟 | 10–10⁴ CFU/cm³ | Malvano 等 (2022) | |
| Escherichia coli O157:H7 | 原料及食品产品的微生物质量控制(猪肉、卷心菜和牛奶) | 近红外响应型光电化学(PEC)传感平台:通过组装柔性导电纸电极,其上负载核壳结构上转换纳米磷光体(UCNPs)@SiO₂@Ag 和碳掺杂石墨烯氮化碳(C-g-C₃N₄),并以抗菌肽 Magainin I 作为识别元件 | 50分钟 | 2 CFU/cm³ | Yin 等 (2022) | |
| 电化学传感器 | 革兰氏阴性菌(如 Escherichia coli) | 评估乳制品腐败情况 | 使用聚乙烯亚胺和聚(钠4-苯乙烯磺酸)修饰的阻抗传感器 | - | 10 CFU/cm³ | Brosel-Oliu 等 (2015) |
| Escherichia coli | 评估乳制品腐败情况 | 金叉指微电极传感器 | - | - | liu 等 (2015) | |
| 传感器阵列 | TMC(总可数微生物) | 原料及食品产品的微生物质量控制 | 由10个金属氧化物半导体气体传感器组成的阵列 | - | - | Yang 和 Wei (2021) |
| Escherichia coli、Klebsiella pneumoniae、Salmonella enterica | 食品安全 | 基于金属氧化物半导体的16个气体传感器阵列 | - | - | Carrillo-Gómez 等 (2021) | |
| 引起奶牛乳房炎的微生物 | 原料的微生物质量控制 | 气体传感器与电导率测量相结合的组合系统 | - | - | Lima 等 (2018) |
基于对牛奶及成品微生物参数检测方法的综述,图4给出了各类方法应用的通用建议。
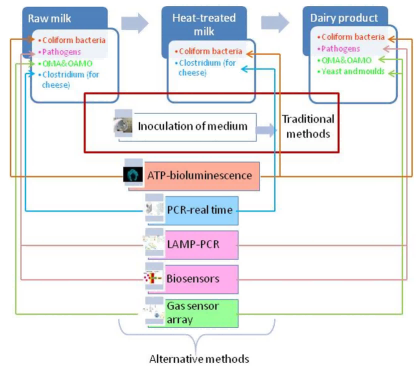
图4.乳品工厂中微生物控制方法的应用示意图
为兼顾特异性、选择性、成本效益与分析时效(≤2小时),推荐组合使用非特异性方法(如ATP生物发光、气体传感器阵列)与特异性方法(如实时PCR、生物传感器)。
结论(Conclusion)
牛奶作为一种复杂多组分产品,其微生物群落极为多样。然而,在加工、运输或储存过程中,可能被致病微生物污染,其含量受到严格监管。预防污染的核心措施包括:仅使用健康动物生产的原料乳、遵守卫生规范、加强员工个人卫生、彻底清洗消毒设备、严格执行原料乳及成品的加工与储存工艺参数。
近年来,科学文献中涌现出大量用于监控牛奶微生物指标的新方法。这些方法相较于传统的微生物培养法更快速、经济且灵敏,能更有效地评估牛奶微生物指标,在乳品工业中具有重要应用价值,是提升质量控制体系的关键一步。
参考文献
1.Abd El Tawab AA, Ammar AM, El-Hofy FI, Aideia HA, Hammad EA (2016) Bacteriological and molecular studies on toxigenic Clostridium perfringens in milk and some milk products. Benha Veterinary Medical Journal 31:144–148. https://doi.org/10.21608/bvmj.2016.31283
2.Briggiler Marcó M, Mercanti DJ (2021) Bacteriophages in dairy plants. Adv Food Nutr Res 97:1–54. https://doi.org/10.1016/bs.afnr.2021.02.015
3.Deng M, Wang Y, Chen G, Liu J, Wang Z, Xu H (2021) Poly-llysine-functionalized magnetic beads combined with polymerase chain reaction for the detection of Staphylococcus aureus and Escherichia coli O157:H7 in milk. J Dairy Sci 104:12342–12352. https://doi.org/10.3168/jds.2021-20612
4.Joshi S, Sharma S, Verma G, Saini A (2022) Peptide functionalized nanomaterials as microbial sensors. In: Nilesh M et al. (eds) Photophysics and Nanophysics in Therapeutics, 1st edn. Elsevier, Amsterdam, pp 327–348.https://doi.org/10.1016/B978-0-323-89839-3.00004-X
5.Zhang M, Li Y, Jing H, Wang N, Wu S, Wang Q et al (2020) Development of polyclonal-antibody-coated immunomagnetic beads for separation and detection of koi herpesvirus in large-volume samples. Arch Virol 165:973–976.https://doi.org/10.1007/s00705-020-04557-y
相关产品
HZB690391:蜡样芽孢杆菌 | Bacillus cereus
HZB124202:产气荚膜梭菌 | Clostridium perfringens
HZB900173:肺炎链球菌 | Streptococcus pneumoniae
HZB355513:荧光假单胞菌 | Pseudomonas fluorescens
敬请关注灰藻生物,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2026-01-29
编制人:思琪
审稿人:小藻
