分子实验笔记06:质粒转入菌体后,液体培养(Liquid Culture)扩增的一般流程
来源:武汉市灰藻生物科技有限公司 浏览量:30 发布时间:2026-01-18 12:43:03
引言(Introduction)
质粒(plasmids)通常携带一个或多个抗生素抗性基因(antibiotic resistance genes),使携带该质粒的细菌对特定抗生素产生抗性。这一特性使研究人员能够通过人工选择(artificial selection)——即在含抗生素的培养基中培养细菌——轻松地从不含质粒的细菌中分离出含有目标质粒的菌株。
Luria肉汤(Luria broth, LB)是一种营养丰富的培养基,广泛用于实验室细菌培养。LB琼脂平板(LB agar plates)常用于分离携带特定质粒的单克隆菌落(clonal colonies)。然而,液体培养(liquid culture)能支持更高密度的细菌生长,适用于扩增足够数量的细菌,以提取足量质粒DNA用于后续实验。以下为接种LB液体过夜培养物的标准操作流程。
操作步骤(Protocol)
1. 配制液体LB培养基。
例如,配制400 mL LB,向500 mL玻璃瓶中加入:
- 4 g NaCl
- 4 g 胰蛋白胨(Tryptone)
- 2 g 酵母提取物(Yeast Extract)
- 加去离子水(dH₂O)至总体积400 mL
注:若实验室已有预混的LB琼脂粉,可按说明书推荐用量直接使用,无需单独称量上述干粉成分。
2. 松松盖上瓶盖(切勿完全拧紧,否则灭菌时可能爆炸!),再用铝箔 loosely 覆盖瓶口。高压灭菌后冷却至室温,再拧紧瓶盖,室温保存LB液体培养基。
3. 准备接种时,将适量LB液体分装至试管或锥形瓶,并加入相应抗生素至终浓度。
注:若计划进行质粒小提(miniprep),通常取2 mL LB于Falcon管中;若需大量提取(如中提或大提),可用高达1 L LB装入2 L锥形瓶(Erlenmeyer flask)中。
4. 用无菌枪头或牙签,从LB琼脂平板上挑取单个菌落。
5. 将枪头或牙签浸入含抗生素的LB液体中,轻轻搅动。
注:也可使用长牙签挑取菌落后,在LB中搅匀,随后取出再进行培养。
6. 用无菌铝箔覆盖培养管口,或使用非密封盖(如透气盖、双位卡扣管、透气膜等),以保证充分通气。
7. 将培养物置于37°C摇床中振荡培养12–18小时。
注:某些质粒或菌株需在30°C下培养。此时因生长速度较慢,可能需要更长时间(如18–30小时)才能达到所需菌体密度。
strong>8. 培养结束后,观察是否生长——成功生长的培养液呈浑浊状(图1)。
注意事项:
• 某些实验要求细菌处于对数生长期(log phase)。请查阅具体实验方案,必要时通过测定OD600来评估菌液密度。
• 良好的阴性对照为:含抗生素但未接种细菌的LB培养基。过夜培养后应无任何生长。
9. (可选)如需长期保存菌种,可制备甘油菌(glycerol stock)。
10. 现可按照“质粒DNA提取”(Isolating Your Plasmid DNA)操作步骤从该培养物中提取质粒DNA。
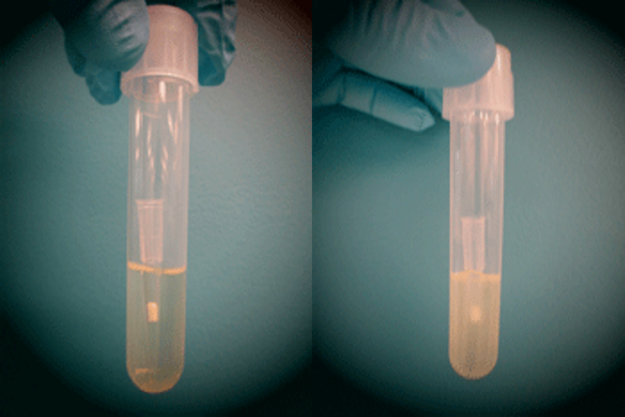
图1:无细菌生长的培养基(左)与有细菌生长的培养基(右)
抗生素配制(Preparing Antibiotics)
1. 配制抗生素母液(stock solution)。
除非另有说明,抗生素粉末通常溶于去离子水(dH₂O)。建议配制1000×母液,分装后–20°C保存。
2. 使用时,按1:1000比例将母液加入LB培养基。
例如:配制100 mL含氨苄青霉素(ampicillin)的LB培养基,需向100 mL LB中加入100 μL 100 mg/mL的氨苄青霉素母液(即1000×)。
常用抗生素及其推荐工作浓度(Antibiotic Concentrations)
| 常用抗生素(Commonly Used Antibiotics) | 推荐工作浓度(Recommended Concentration) |
|---|---|
| Ampicillin(氨苄青霉素) | 100 µg/mL |
| Bleocin(博来霉素) | 5 µg/mL |
| Carbenicillin(羧苄青霉素) | 100 µg/mL |
| Chloramphenicol(氯霉素) | 25 µg/mL |
| Coumermycin(香豆霉素) | 25 µg/mL |
| Gentamycin(庆大霉素) | 10 µg/mL |
| Kanamycin(卡那霉素) | 50 µg/mL |
| Spectinomycin(壮观霉素) | 50 µg/mL |
| Tetracycline(四环素) | 10 µg/mL |
技巧与常见问题(Tips and FAQ)高拷贝质粒与低拷贝质粒有何区别?
“拷贝数”(copy number)指单个细菌细胞内某一质粒的拷贝数量(图2)。
• 大片段质粒通常为低拷贝(low copy),每细胞仅含1–2个拷贝,需培养18–30小时才能获得足够菌量。
• 小质粒则多为高拷贝(high copy),每细胞可达50个以上拷贝,通常培养12–16小时即可。
• 某些质粒即使较小,也可能因含有特殊调控元件而表现为低拷贝。请查阅您所用质粒的信息页面,确认其拷贝类型。
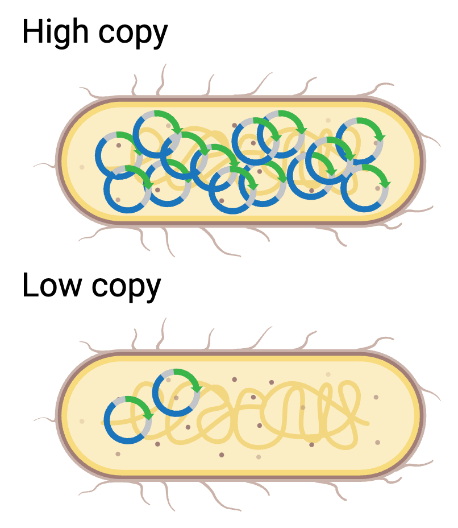
图2:细菌中高拷贝与低拷贝质粒示意图(由 BioRender.com 制作)过夜培养后无任何生长,可能原因是什么?
- 延长培养时间:某些菌株生长缓慢;若在30°C而非37°C培养,通常需更长时间。
- 确认抗生素匹配:确保LB中添加的抗生素与质粒所携带的抗性基因一致。
- 使用新鲜平板菌落:若平板上的菌落不新鲜(如存放过久),应先划线接种新平板,再挑取单菌落进行液体培养。
- 增加通气量:通常摇床转速为150–250 rpm,可提高至350–400 rpm以提升菌体密度。
参考文献
https://www.addgene.org/
敬请关注灰藻生物,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2026-01-14
编制人:磊子
审稿人:小藻
