分子实验笔记04:构建重组质粒之DNA连接(DNA Ligation)
来源:武汉市灰藻生物科技有限公司 浏览量:35 发布时间:2026-01-16 09:29:39
引言(Introduction)
构建重组质粒的最后一步,是将目标插入片段(insert DNA,即目的基因或DNA片段)连接到经兼容性酶切处理的载体骨架(vector backbone)中。这一过程通过共价连接两个DNA片段的糖-磷酸骨架实现,所依赖的反应称为连接(ligation),由T4 DNA连接酶(T4 DNA ligase)催化完成。T4 DNA连接酶催化形成共价磷酸二酯键(covalent phosphodiester linkages),从而将核苷酸永久连接在一起。连接完成后,插入片段与载体骨架物理结合,形成完整的环状质粒,即可转化入细菌细胞进行扩增(propagation)。
大多数连接反应所用的DNA片段均来源于限制性内切酶消化(restriction enzyme digestion)。多数限制性内切酶在其识别序列上不对称切割,产生带有单链突出末端(single-stranded overhang)的DNA片段。这种突出末端被称为“黏性末端(sticky ends)”,正是它使载体与插入片段能够相互结合。当载体与插入片段的黏性末端互补配对(即突出的碱基序列彼此互补)时,两段DNA可暂时退火结合,并最终在连接酶作用下共价融合。
下图展示了经 EcoRI 酶切后产生的两个黏性末端的连接过程:
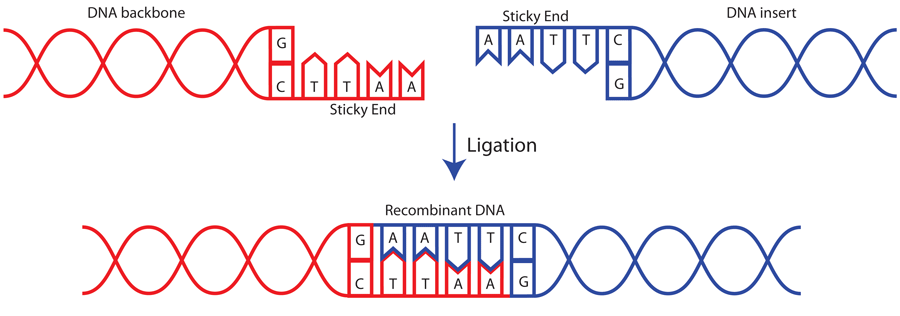
图1 EcoRI酶切产生的两个黏性末端的连接过程
通常,科学家在将插入片段克隆至载体时,会选用两种不同的限制性内切酶——一个用于5'端,另一个用于3'端。这样可确保插入片段以正确方向(orientation)插入,并防止载体在连接过程中发生自连(self-ligation)。若载体两侧的黏性末端彼此兼容(即能互相配对),则载体极易自连而非与插入片段连接。在此情况下,必须在连接前对酶切后的载体骨架进行碱性磷酸酶(phosphatase)处理:该酶可去除DNA 5'端的磷酸基团(5' phosphate),从而阻止连接酶将载体两端重新连接成环。
标准插入片段 + 载体DNA连接方案(Protocol: Standard Insert + Vector DNA Ligation)
在设置连接反应前,需先确定所用酶切后插入片段与载体的用量。具体体积取决于两者的浓度和大小。对于大多数常规克隆(插入片段小于载体),推荐使用3:1 的插入片段:载体摩尔比(molar ratio)。我们建议每次标准连接反应中总DNA量约为 100 ng。1. 在PCR管或Eppendorf管中混合以下组分:
- 载体DNA(Vector DNA)
- 插入片段DNA(Insert DNA)
- 连接酶缓冲液(Ligase Buffer):
• 若为10×缓冲液,每10 μL反应加1 μL;
• 若为5×缓冲液,每10 μL反应加2 μL - T4 DNA连接酶:0.5–1 μL
- 用去离子水(H₂O)补足至总体积10 μL
注意事项:
• 若DNA浓度过低,无法在10 μL体系中加入100 ng总DNA、缓冲液和连接酶,可按比例扩大反应体系,但需同比例增加缓冲液用量。对于较大体积的连接反应,1 μL连接酶通常已足够。
• 连接酶缓冲液含ATP,而ATP在反复冻融中易降解。建议取一支新缓冲液,一次性解冻后分装为5 μL、10 μL或20 μL小份,–20°C保存。后续实验每次使用一管仅解冻过一次的分装液。
• 务必设置对照!详见下方“技巧与常见问题”。
• 可尝试不同载体:插入片段比例以优化连接效率,详见下方优化建议。2. 将反应管置于室温孵育2小时,或16°C过夜(请遵循厂商说明书)。
注:许多连接反应(尤其是使用“高浓度”连接酶时),室温孵育5分钟即足够。对于较难连接的情况(如退火寡核苷酸的连接),37°C孵育可提高连接效率。3. 连接完成后,直接进行细菌转化(bacterial transformation)。

图2 DNA连接酶
技巧与常见问题(Tips and FAQ)必须设置对照(Do controls)
进行连接实验时,务必设置“仅载体 + 连接酶”对照(vector alone + ligase control)。该对照可用于验证:
• 载体是否被完全酶切;
• 若进行了磷酸酶处理,该处理是否有效。
理论上,此对照应无菌落生长,但实际操作中常有少量背景菌落。关键在于:您的“载体+插入片段”连接组应产生显著多于该对照的菌落数。
鼓励设置更多对照,尤其在连接失败需排查原因时。下表列出了常用对照及其意义:
| 对照类型(Control) | 是否加连接酶(Ligase) | 结果解读(Interpretation) |
|---|---|---|
| 未酶切载体(Uncut vector) | – | 验证感受态细胞活性及质粒抗生素抗性是否正常 |
| 酶切载体(Cut vector) | – | 检测因未完全酶切而残留的完整载体造成的背景 |
| 酶切载体(Cut vector) | + | 检测载体自连背景——对经磷酸酶处理的载体尤其重要 |
| 仅插入片段或水(Insert or water) | + | 若有菌落,表明连接或转化试剂中存在完整质粒污染优化载体:插入片段比例(Optimizing the Vector:Insert Ratio) |
虽然3:1(插入:载体)的摩尔比通常适用,但在该比例效果不佳或进行复杂克隆时,可进一步优化比例。需注意:所谓“3:1”实际上是指可用于连接的DNA末端摩尔数之比。
简单来说,无论DNA片段多长,每条线性DNA分子仅有两个末端。因此,为达到“每1个载体末端对应3个插入片段末端”的理想比例,必须根据DNA片段的实际长度调整其质量用量。
例如:若载体为5 kb,插入片段为1 kb,则相同质量下,插入片段的摩尔数是载体的5倍。此时若仍按质量比3:1加入,实际末端摩尔比将远高于3:1,可能导致多联体(multimer)形成。因此,应通过计算调整质量比,使末端摩尔比接近3:1,以获得最佳连接效率。

图3 插入片段比例参考公式
参考文献
https://www.addgene.org/
敬请关注灰藻生物,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2026-01-14
编制人:磊子
审稿人:小藻
