亨盖特厌氧滚管技术(Hungate Anaerobic Roll-Tube Technique):原理、操作与应用指南
来源:武汉市灰藻生物科技有限公司 浏览量:745 发布时间:2025-09-16 21:23:50
引言
厌氧微生物在自然界和工业应用中扮演着重要角色,但其分离与纯化,因对无氧环境的严苛要求而极具挑战性。
亨盖特厌氧滚管技术自20世纪50年代,由美国微生物生态学家亨盖特发明以来,已成为分离严格厌氧微生物的核心方法。
该技术通过巧妙的操作设计,无需依赖昂贵的厌氧手套箱,即可实现无菌、无氧条件下的,微生物培养与分离。
本文系统介绍了亨盖特滚管技术的原理、操作流程及注意事项,并重点探讨其在普通实验室条件下的可行性,旨在为厌氧微生物研究者提供实用、经济的实验方案。
厌氧微生物滚管分离技术
亨盖特厌氧滚管技术(Hungate Anaerobic Roll-Tube Technique)由美国微生物生态学家亨盖特于20世纪50年代发明,是一种用于厌氧微生物分离和纯化的方法,并经后续研究者不断改进。该技术适用于多种严格厌氧微生物的分离纯化,包括硝酸盐还原菌、发酵型细菌、硫酸盐还原菌等。本实验室已将其应用于纤维素发酵产燃料的梭状芽孢杆菌、六价铬生物修复相关的,硝酸盐还原菌和硫酸盐还原菌等的分离。不同厌氧实验室的具体操作可能有所差异,本文主要介绍厌氧菌分离纯化的基本操作流程与原理,并强调该方法无需使用滚管机,普通实验室也可开展相关实验。
厌氧操作需重点关注两方面:无菌与无氧。
无菌:
与好氧微生物实验相同,厌氧操作也需严格遵循无菌原则。在通氮气维持厌氧环境时,应利用酒精灯火焰对管口进行灭菌。使用注射器转接培养物前,需用酒精棉片或棉球擦拭滚管橡胶塞表面。
若橡胶塞意外接触其他表面,应重新消毒后再盖回。在厌氧手套箱内操作时,因无法使用明火,需尽量缩短培养物在气相中的暴露时间,以降低污染风险。
无氧:
在开放实验台上操作时,需持续通入氮气以维持厌氧环境。由于与空气相通,气流扰动可能引入少量氧气,因此应尽量缩短操作时间,减少氧气对厌氧菌的抑制。
若仅需从一支厌氧滚管中,挑取一个菌落并快速转接至液体培养基,可短暂开放操作;但若需从同一管中挑取多个菌落,则需持续通氮气保护。具体操作应根据菌株的耐氧性灵活调整。
亨盖特厌氧滚管技术分离严格厌氧微生物
1 进行滚管实验时,所有厌氧试管应保持无菌和无氧状态,注射器及针头需灭菌并烘干。
2 氮气经橡胶管过滤除菌后通入厌氧试管,另一注射器作为出气口,用于接种注射器的氮气置换与除氧。操作时应在氮气出口附近放置火焰,以保证无菌环境。
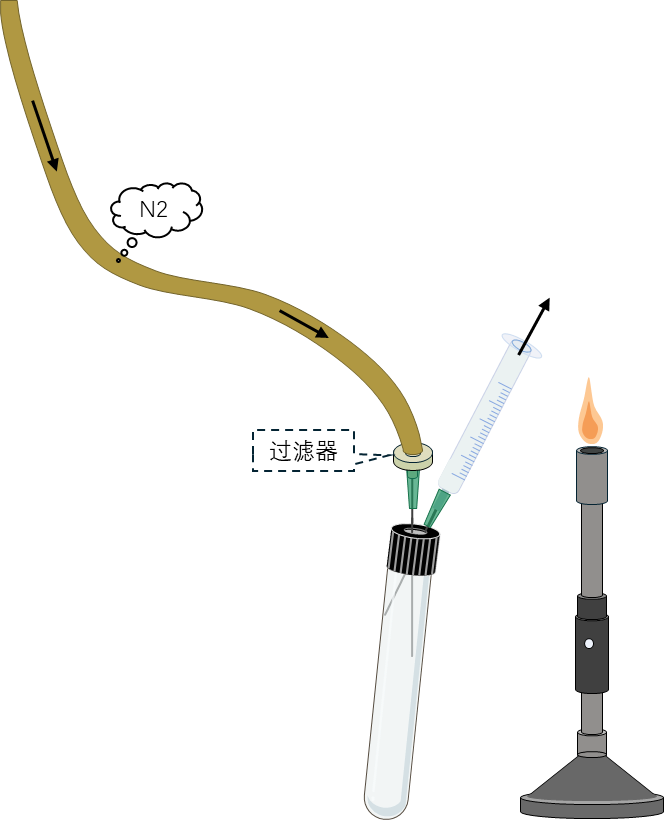
3 将接种注射器的针头插入,作为出气口的注射器中,抽吸换气3–5次以置换注射器中的残留氧气。
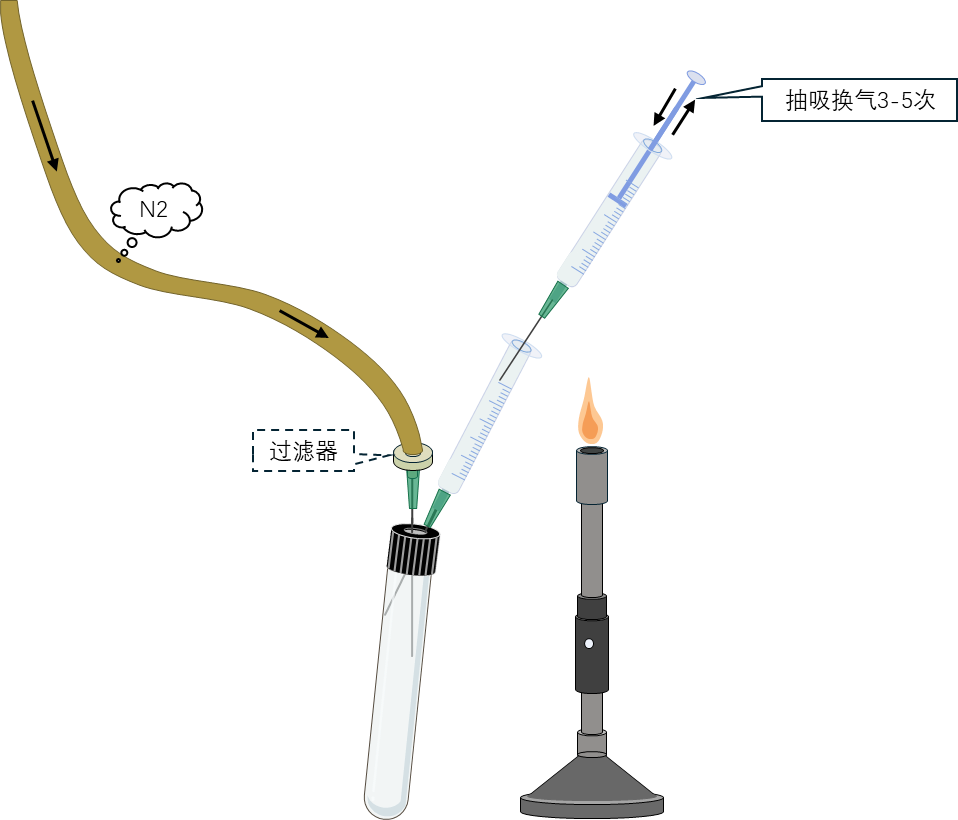
4 用酒精擦拭装有样品,或富集培养物的厌氧试管管口,晾干或用少量酒精灼烧灭菌。
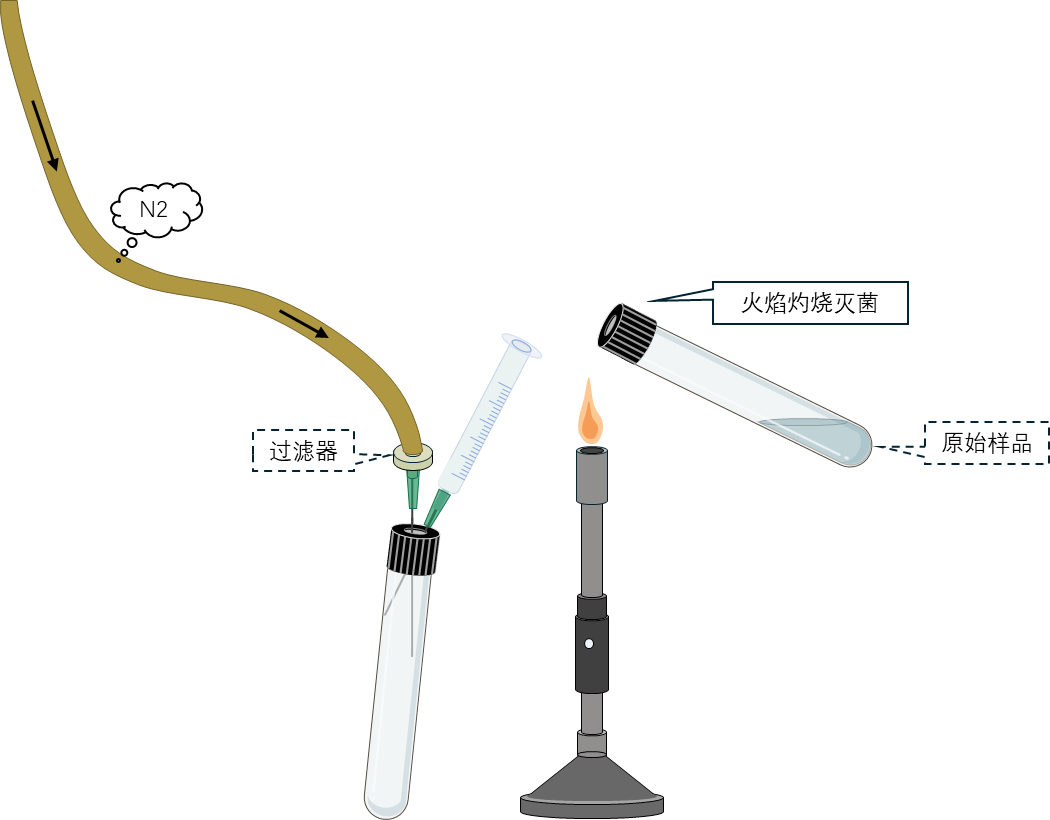
5 用经氮气置换的注射器吸取0.05–0.5 mL样品,注入第一支已预热至50–55°C水浴中并液化的琼脂培养基试管中,涡旋混匀后,用新注射器吸取0.5 mL,转接至另一支含5 mL培养基的试管中,进行10倍系列稀释。
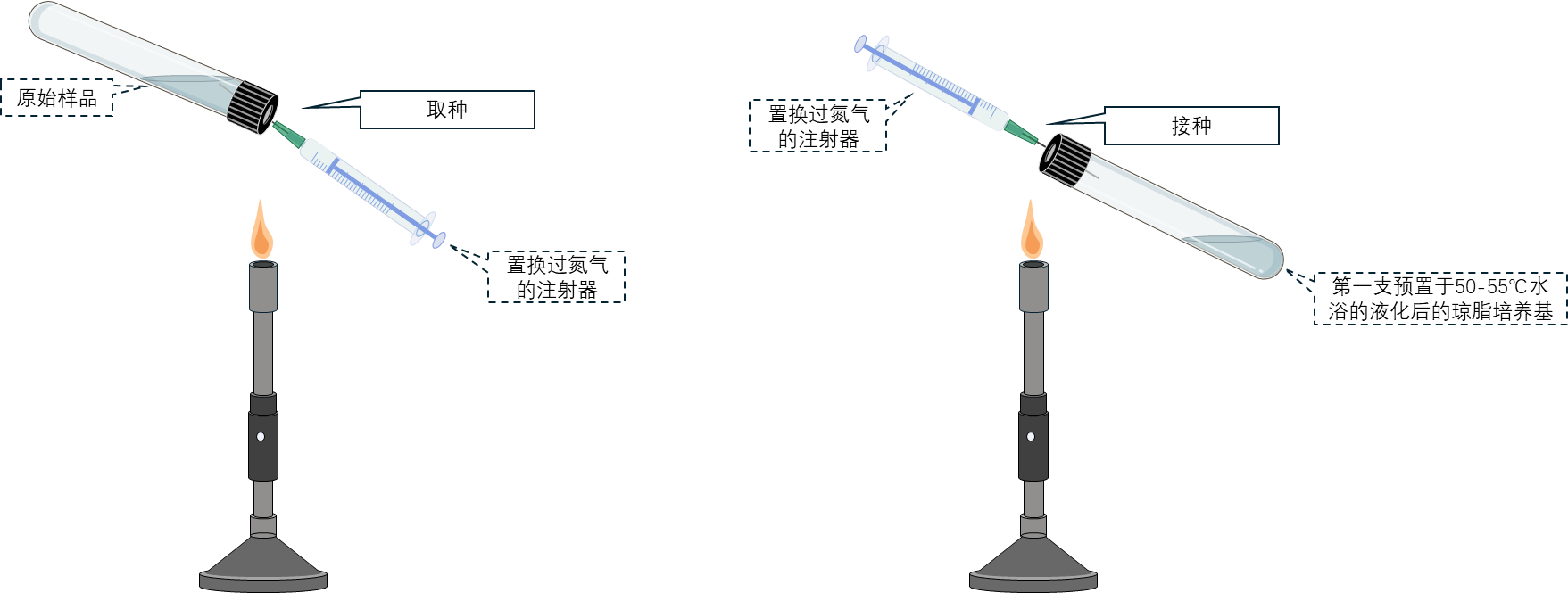
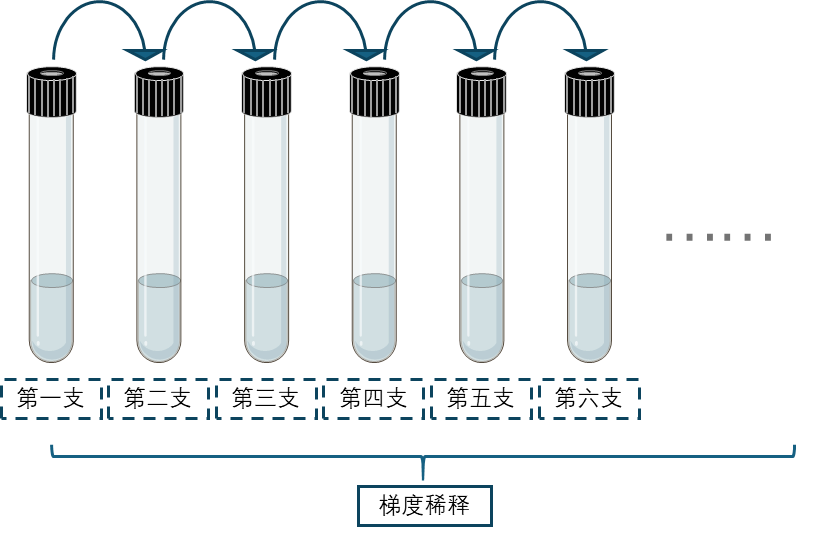
6 稀释完成后,将接种后的琼脂培养基,轻轻上下颠倒混匀,置于冰水混合物中滚动试管直至琼脂凝固。

厌氧滚管中菌落的显微形态观察
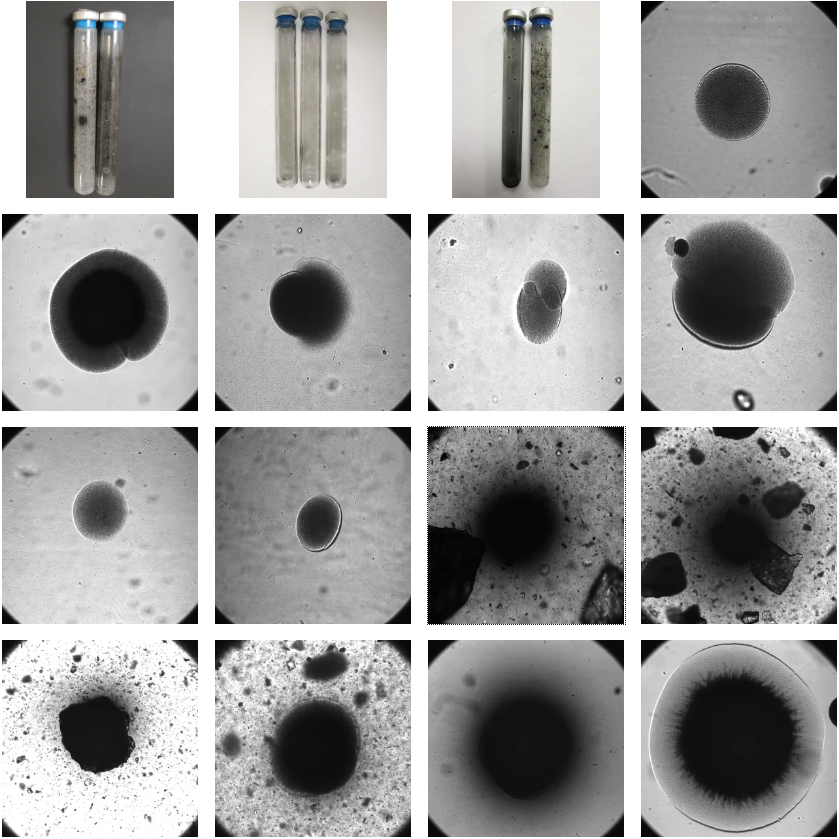
滚管技术的一大优势是,可在肉眼或低倍显微镜(4×或10×)下,直接观察菌落形态与纯度,判断是否为单一菌落。
相比之下,其他方法(如倒置琼脂法或液体终点稀释法)难以确认所挑取的是否为单菌落。因此,在阅读文献时需注意方法差异可能对结果和结论产生影响。
从滚管中挑取单菌落,转接至液体培养基
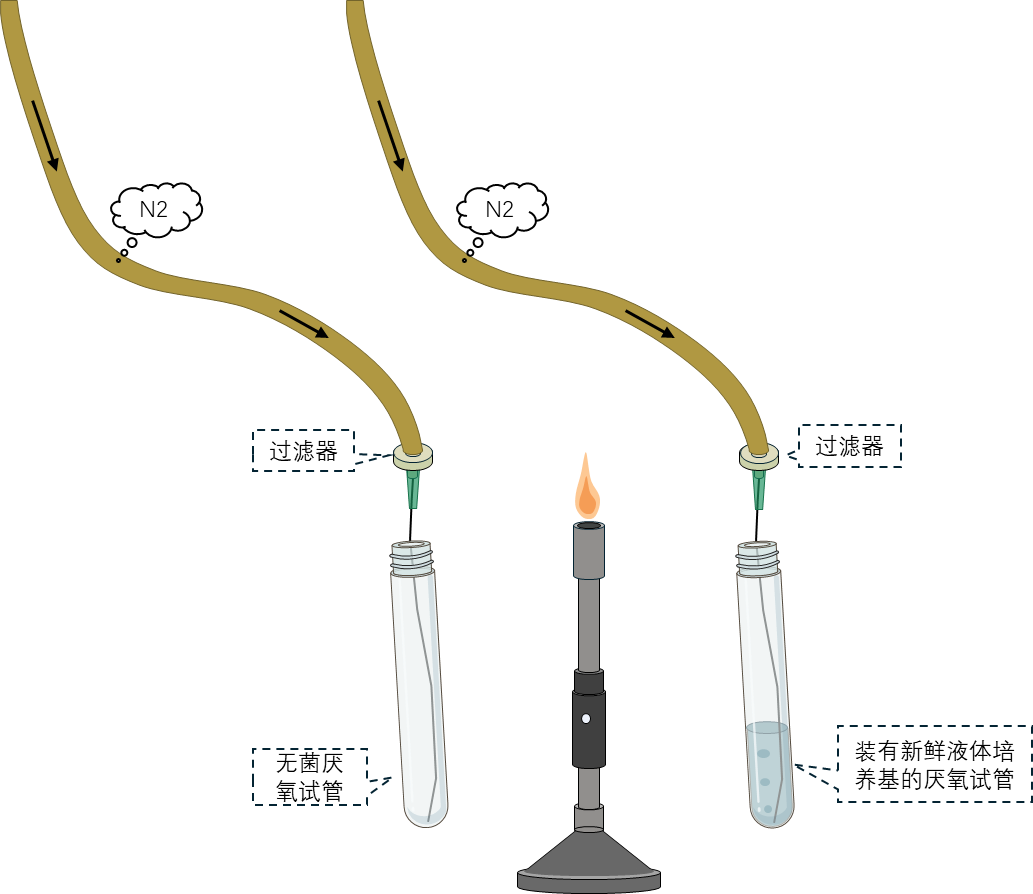
1 准备一支无菌厌氧试管,插入长针头通入经过滤的氮气至管底,确保内部厌氧环境,该管用于玻璃吸管的氮气置换。
2 另准备一支装有新鲜液体培养基的厌氧试管,同样通氮气保持无氧状态,用于细菌接种后的生长。
3 全程需严格保持无氧和无菌操作,两支试管旁均应放置火焰。
4 厌氧菌落吸管由普通长尖头巴斯德吸管改制:将其尖端0.5–1 cm处在火焰上轻度加热,玻璃软化后尖端自然下垂,形成弯头。需确保尖端不变形、内部通道畅通,方可使用。
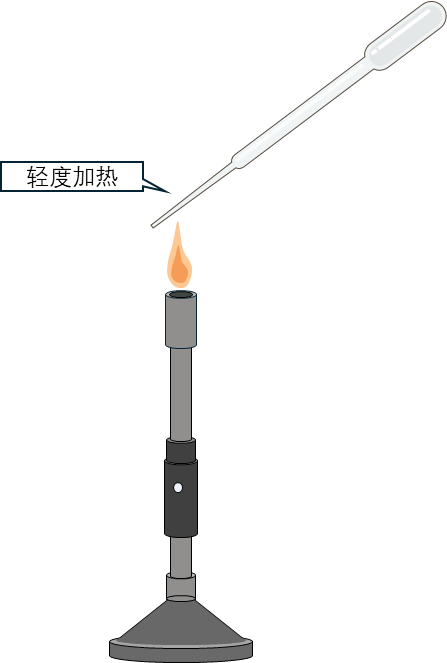
5 吸管另一端用棉花堵塞,防止杂菌进入,灭菌烘干后备用。在棉花端套上橡胶头,即可用于气体置换和菌落吸取。
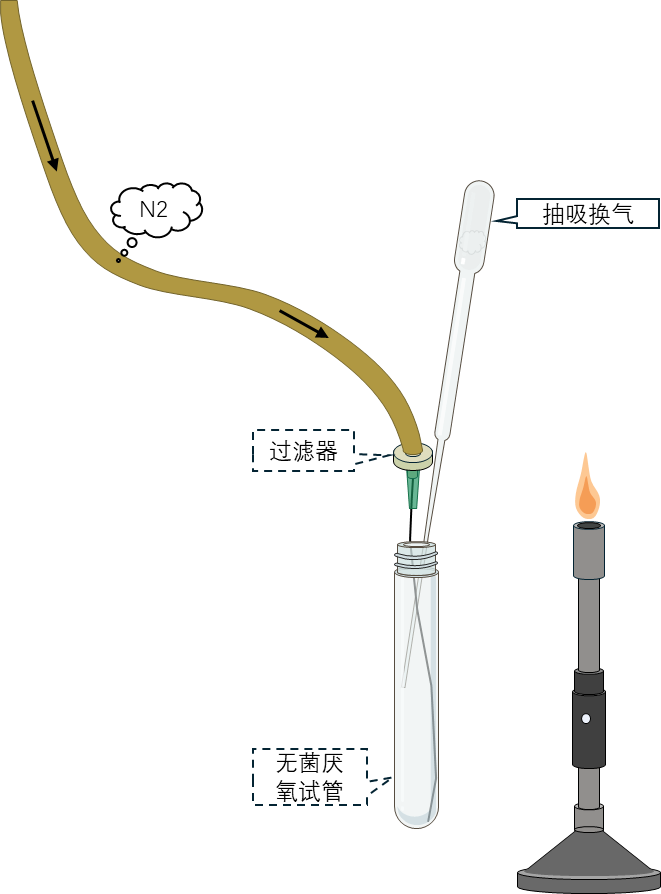
6 打开含目标菌落的厌氧试管橡胶塞,将置换完毕的吸管伸至菌落上方,捏紧橡胶头后将弯尖头插入菌落,松开橡胶头,即可吸入带菌落的小块琼脂。
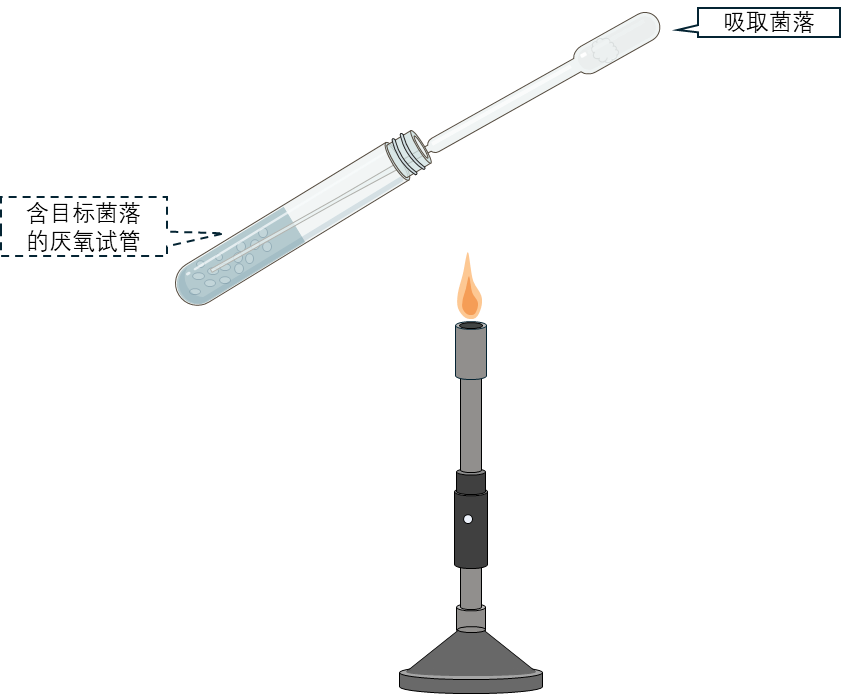
7 将吸管转移至装有新鲜培养基的厌氧管中,将尖头插入液面以下,反复抽吸使琼脂块分散于培养基中。
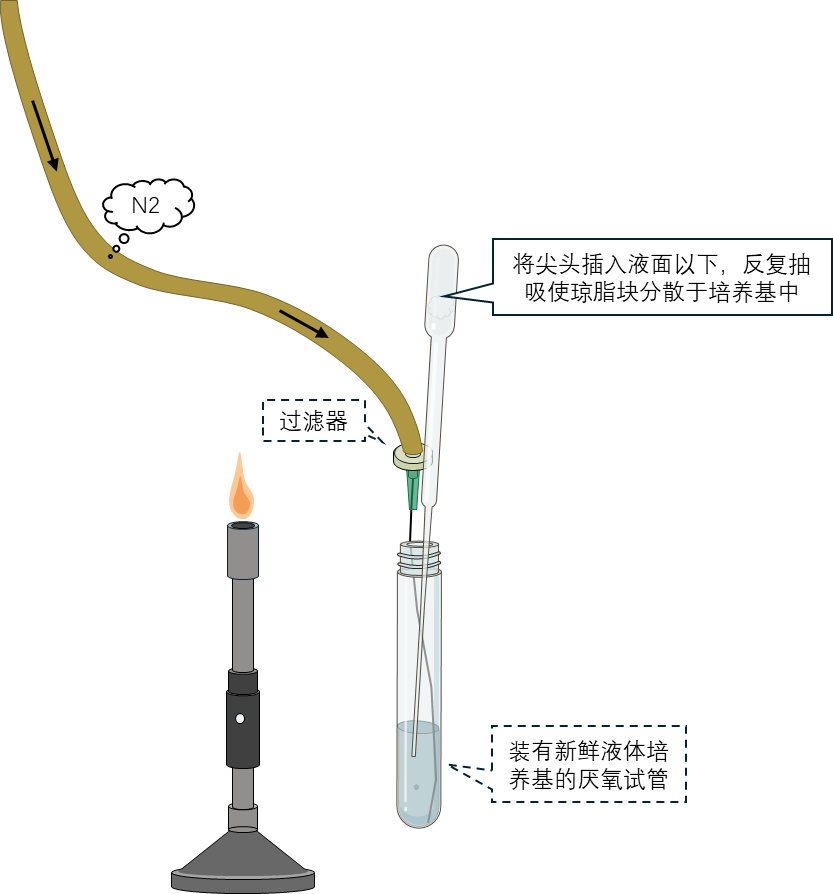
8 挑取完成后,用酒精消毒橡胶塞并迅速盖紧试管。
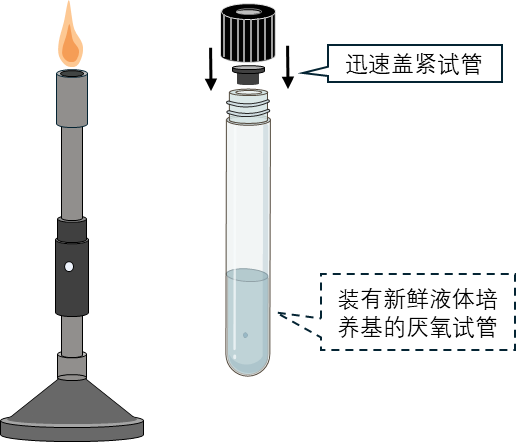
9 最后应确认琼脂块是否悬浮在液体培养基中。
纯培养物的镜检验证
通过形态学确认纯培养的标准如下:
1 滚管中的菌落经镜检为单一形态;
2 由该单菌落培养出的液体培养物细菌形态一致。
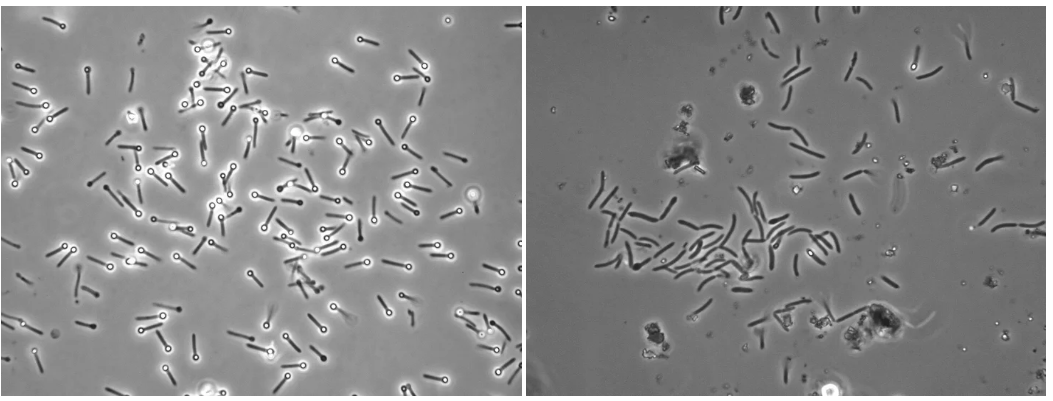
为进一步纯化,可重复滚管挑取菌落操作。
对无厌氧手套箱实验室培养厌氧菌的指导意义
对于不具备厌氧手套箱的实验室,亨盖特滚管技术仍可,通过以下措施实现厌氧菌的有效培养:
1 维持局部无氧环境:通过持续通入过滤除菌的氮气,并在操作区域附近放置火焰,以减少氧气渗入和污染风险。
2 优化操作效率:尽量缩短试管开口时间,快速完成接种、稀释和挑取步骤,避免厌氧菌暴露于氧气。
3 灵活调整操作:根据菌株的耐氧性选择开放或持续通氮操作模式(例如单菌落挑取可短暂开放,多菌落操作需持续通氮)。
4 利用简易工具替代:如自制弯头吸管用于菌落挑取,并通过氮气置换确保工具内部无氧。
5 强化无菌意识:尽管无明火环境(如手套箱内)操作受限,但在开放台面上需坚持火焰灭菌和酒精消毒,以杜绝污染。
这些措施使得普通实验室也能高效开展厌氧微生物研究,降低了技术门槛与设备成本。
总结
亨盖特厌氧滚管技术是一种经济、高效且适应性强的厌氧微生物分离方法。其核心优势在于,通过简单的设备(如氮气置换、注射器操作和火焰灭菌)即可实现无菌、无氧环境,无需依赖昂贵的专用设备。技术流程涵盖从样品稀释、滚管凝固,菌落挑取和纯培养验证的全过程,强调操作中需严格兼顾无氧与无菌两大原则。此外,滚管法可直接观察菌落形态,确保单菌落分离的可靠性,优于其他间接方法。本技术已成功应用于纤维素降解菌、硝酸盐还原菌及硫酸盐还原菌等多种厌氧菌的分离,具备广泛的科研与实用价值。
参考文献
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-09-14
编制人:小灰
审稿人:小藻
