标准菌株的定义,菌株小于5代内使用的黄金法则由来?
来源:武汉市灰藻生物科技有限公司 浏览量:473 发布时间:2025-10-16 16:14:38
引言
“标准菌株”这个概念在国内使用甚广,但是很多科研人员和使用者,其实对标准菌株的概念并无清晰认识。
本文将对标准菌株的定义、延伸概念、以及各概念的适用场景,进行一系列的说明,同时解释“菌株要在5代内使用”说法的由来。
标准菌株定义
根据现行国家标准《实验室质量控制规范-食品微生物检测》(GB/T 27405-2008)第3节中的术语和定义,标准菌株(reference strain)是至少定义到属或种水平的菌株,按其特征进行分类和描述,有明确的来源。
延伸理解后可进一步认为,标准菌株是来自受认可的国内外权威保藏机构,提供的原始菌株(或其它执行标准较高的派生菌株)。
比如,美国ATCC,德国DSMZ,日本JCM/NBRC,荷兰CBS,瑞典CCUG等海外权威保藏中心,以及国内的中国医学细菌保藏管理中心CMCC等。

ATCC冻干安瓿工艺
# 事实上,即使是这些专业保藏机构,有能力(资金、人力、时间等成本),且有意愿对本机构保藏菌株进行检查和鉴定,若要对纯度、活性、以及基因等进行全面检测并坚持执行,仍是一项富有挑战的工作。
标准菌株相关延伸概念
标准储备菌株(reference stocks):标准菌株经过一代转接后获得的同种菌株。
应定期对其进行纯度和特性确认,推荐使用真空冻干法(冷冻干燥)、液氮或超低温冷冻保存,冷冻菌种避免反复冻融,并验证不同方法的保存时间。
工作菌株(working cultures):由标准储备菌株转接后获得的同种菌株。
标准培养物( reference cultures):标准菌株、标准储备菌株和工作菌株的统称。

实验室质量控制规范
根据《2023版GMP指南(5): 菌种管理》的描述,
“使用与标准菌株所有特性等效的,可以追溯的商业派生菌株”、
“工作菌株不可重新制备为标准菌株,标准菌株的商业衍生物仅可用作工作菌株”。
# 注:更严谨地说应当是,非严格标准条件下,不可将其重新制备为标准菌株,若执行类似ATCC的标准,本身便是制备标准菌株的流程,便无可挑剔。
这里的重点是,使用派生菌株要有明确溯源,同时要进行纯度和特性鉴定工作。
另外,规定了,工作菌株和标准菌株的商业衍生物,不能作为标准菌株用于制备标准储备菌株。
但未规定工作菌株不得用于传代,那么也就是说商业衍生物及其传代菌株,在有明确溯源和验证工作的基础上,可以作为工作菌株使用。
# 注意事项:
常用的标准菌株保存时,建议应有两套。一套供保存传代用,另一套供日常使用时。
传代次数应严格控制,不得超过5代,防止过度传代增加菌种变异风险,标准菌株的商业衍生物仅可用于工作菌株。
为便于理解,在学术和工业实践中,标准菌株应具备以下特征:
身份准确,生物学分类,如种属信息无误,可通过16S rRNA测序等方法确定;
溯源清晰,通常具备国际权威保藏中心(如ATCC、DSMZ、CCTCC等)的保藏编号;
特征典型,表型和基因型特征明确等;
遗传稳定,多次传代后,典型特征可保持稳定。
黄金法则:工作菌株5代内使用
根据《中国药典:2020年版·四部-9203药品微生物实验室质量管理指导原则》,工作菌株的传代次数应严格控制在5代以内。起始代数为从菌种保藏机构获得的标准菌株,计为第0代。
根据《美国药典》(USP<51>)要求,用于抗菌效力测试的菌种,其ATCC原代菌种传代次数不得超过5次。
在具体操作中,一次传代被定义为,将活的培养物接种到新的微生物生长培养基中进行培养。
无论形式如何,任何转种操作均被视为一次传代。为了确保实验结果的准确性和可靠性,实验室在有必要时需对工作菌株的特性和纯度加以确认。
这一规定的设置旨在,防范多次传代所可能导致的菌种遗传变异风险,但是“药典”中的表述,让研究人员很容易混淆“传代”与“代”的概念,日常使用中经常就会听到“这是几代菌”这样的表述。
细菌分裂一次其实也就是十几分钟,5代也就1小时的事情。“这是几代菌”实际上指的是,研究人员接收保藏中心的原始菌株后,传代操作做了几次。
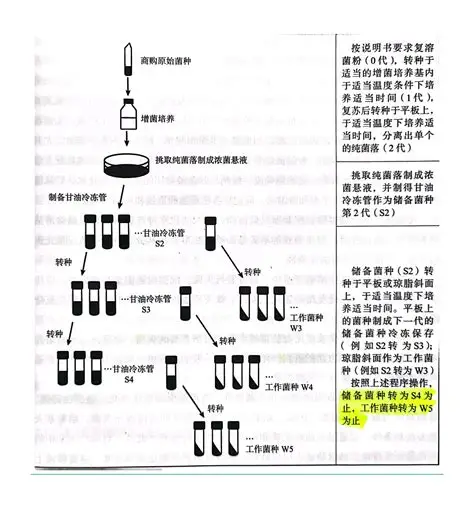
菌株保存及传代流程图,S为储存菌株,W为工作菌株
# 常见问题
Q1 菌种传代次数必须在5代以内?超过5代是否可行?
5代以内使用的规定的,原本旨在防范多次传代可能导致的遗传变异风险。
因为繁殖快,微生物的遗传特性才得以明显表达,微生物才更能适应外界环境压力的变化。但是只要生长,或者说产生分裂,都可能产生变异。将菌种的传代次数控制在5代以内,是一项经过长期实践验证的经验结论。
这一指导原则的确立,旨在避免多次传代可能导致菌种遗传特性丧失或者发生变异,而变异可能影响其在研究和生产中的稳定性和生物活性。
通过限制传代次数至5代以内,可以有效减少遗传变异的风险,从而确保菌种在实验和生产中保持稳定的遗传特性及生物活性。这不仅提升了实验的可靠性,也保障了生产环节的产品质量。
遵循传代控制要求,不仅是对实验结果的一种保障,也是对菌种长久稳定利用的责任。因此,这一经验值在许多专业领域被广泛认可和应用。
# 超过5代是否可行?
“5代”这一限制既是基于长期微生物学实践经验的总结,也具有一定的理论依据。
在许多生物技术应用中,遵循这项传代限制已经成为确保实验和生产一致性的重要保障。通过严控传代次数,科学家可以更大程度地确保结果的可重复性和产品的高质量。
根据微生物学常识,菌种的传代次数与其遗传变异率之间存在正相关关系:传代次数越多,变异的风险也就越高。
虽然技术上并非完全禁止使用超过5代的菌种,但在超过5代后,菌种的稳定性和可靠性可能会受到挑战,增加意外问题出现的可能性。
若经过5代传代后,经过鉴定检查,菌种的形态结构、生理生化特性等依然保持不变,可以考虑继续使用。
但即便如此,多个传代在实验过程中仍然被不建议,因为这会显著增加变异和风险的可能性。
严格控制菌种传代在5代以内是,基于丰富的实践经验总结而来的最佳实践方法,以确保实验和生产流程在准确性和可靠性上保持不变。
坚持这一经验法则不仅是在保证实验结果的一致性,更是在规避不必要的研究风险。
Q2 如何确认是哪一代菌种?
在实际实验室环境中,有些实验室对菌种管理极为严格,而另一些实验室可能显得较为混乱。
由于实验的人员频繁更替和菌种的频繁使用,有时会出现难以追踪菌种代数的问题。面对这种普遍现象,我们只能以收到的菌种作为基础,将其视为第0代。
当接收到新的菌种时,我们首先需要进行,简单的形态学鉴定,以及生理生化特性检测,以评估菌株活力。
同时,扩增子测序鉴定也随着技术发展,愈来愈流行,可迅速实现菌株污染和纯度鉴定,缺点是种内污染难以区分。
如果这些指标没有问题,那么该菌种可以被视为F0,即母代菌种。但需要明确的是,这样的做法并不符合《中国药典》中规定的标准第0代菌种。
这种方法仅作为临时参考,并不适用于严格要求的实验环境。为了确保实验的稳定性和可靠性,还是应尽力遵循规定的实验菌种管理流程,标准化菌种的保存和使用,以避免在传代过程中出现更多不确定性。
Q3 商业公司提供的标准菌株衍生物,与权威保藏中心的差别是什么?
顾名思义,衍生物最初就是由标准菌株传代加工而来,即标准菌株的子代产品。
结合《2023版GMP指南(5): 菌种管理》的描述,对于标准菌株,要求定期进行纯度和特性验证,工作菌株则是必要时进行纯度和特性验证。
因此,我们认为标准菌株衍生物可用于传代,作为工作菌株使用,但是不能作为标准储备菌株;每次传代都应该对纯度、特性等与实验相关的关键指标的确认,并且最好不要传代超过5代。
对于一些即用型产品,如定量菌株,理论上不应继续传代。
收到原始菌株时,每次传代多制备一批,即可满足日常工作需要,不建议使用工作菌株连续传代。
总结,标准菌株衍生物就是标准菌株的子代产品,或者子代工作菌株,其质量受保藏单位的工艺标准影响。
理论上,对于严格执行保藏质控流程的公司,其衍生物和标准菌株差距并不明显(一些容易产生突变的菌株除外)。
Q4 日常科研和生产使用的菌株,应当满足哪些标准?
最理想的情况是,所有实验样本,均使用来自权威保藏中心的标准菌株;
实际情况是,即使原代菌株是标准菌株,为了满足工作需要(数量),也需将其传代扩增,制备为标准储备菌株和工作菌株,最终用于科研和生产的为工作菌株。
遵循黄金法则,尽量使用5代以内的工作菌株最佳。
因此,我们的选择范围有以下几种:
(1)权威保藏中心提供的标准菌株,自行按照标准流程,将其传代扩增获得的工作菌株;
(2)普通保藏中心提供的菌株,受限于自身资源,有些保藏中心并不能,完全执行高标准的保藏收纳流程,其生物样本的复苏活性、表型特征、基因信息等,相比于ATCC、DSMZ、JCM、CCUG等国际知名保藏中心,仍具有明显差距,而且其可参考的文献信息也相对较少。但胜在资源多样性丰富,可作为我们的备选项;
(3)标准菌株衍生物,即传代后的工作菌株(按标准的保藏流程,一般为2-3代)。
这个范围包括:私立运营的菌株库、大型企业的功能菌株库(比如某些药厂自建的病原菌库)、实验室的小型菌库(高校、研究所、医院等),这些单位有时候,也作为保藏中心生物资源的原始来源。
Q5 如何建成和维护一家微生物保藏中心,并得到业内认可?
首先,要明确各大保藏中心均不以营利为目的,多是政府支持成立的公益性组织,其营收一般用来自身运营和科研支撑。
尽管组织架构方式不完全一样,但若要得到业内普遍认可,维护生物样本质量,肯定有一些必要程序须遵守和执行,我们将在另一篇专栏中,整理世界微生物菌种保藏中心联合会(WFCC),关于生物样本保藏的管理指南,供研究人员参考。
文章跳转:《微生物资源保藏中心的成立背景、目标使命、质量标准和其它相关事项说明(基于世界微生物联合委员WFCC指南)》,访问链接: https://www.huizaobio.com/article/a365.html
参考资料
《实验室质量控制规范-食品微生物检测》(GB/T 27405-2008)
《2023版GMP指南(5): 菌种管理》
《中国药典:2020年版·四部-9203药品微生物实验室质量管理指导原则》
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共同创造生命科学的未来!
更新日期:2025-08-28
#创作团队
编制人:小藻
审稿人:小藻
