无机自养型亚硝酸盐氧化细菌的形态学、生理生化特性、分离培养及菌种保藏方法(第二卷 变形菌门 Part A, Page 161))
来源:武汉市灰藻生物科技有限公司 浏览量:355 发布时间:2025-11-07 15:14:52
前言
化能无机营养型亚硝酸盐氧化菌(Lithotrophic Nitrite Oxidizers)是一类革兰氏阴性真细菌(Gram-negative eubacteria),能够以亚硝酸盐(nitrite)作为唯一能量来源,并以CO₂为主要碳源。
部分菌株可进行混合营养生长(mixotrophic growth)。除硝化杆菌属(Nitrobacter)外,这类微生物均为专性无机自养型(obligate lithoautotrophs);而硝化杆菌属还可进行异养生长(heterotrophic growth)。
研究表明,硝化杆菌属甚至,可通过异化硝酸盐还原(dissimilatory nitrate reduction)厌氧生长。
一、形态学特征
亚硝酸盐氧化菌在形态上具有多样性,包括杆状、球状和螺旋状菌体。传统上,其属级分类主要依据,细胞形态和胞内膜(intracytoplasmic membranes)排列方式,分类体系基于谢尔盖·维诺格拉茨基(Sergei Winogradsky)和海伦·维诺格拉茨基(Helene Winogradsky)的研究。
目前,已明确鉴定的,4个形态学差异显著的属,包括:
硝化杆菌属(Nitrobacter):多形性短杆状菌,胞内膜呈极冠状(polar cap)排列;
硝化球菌属(Nitrococcus):球状细胞,具管状胞内膜;
硝化刺菌属(Nitrospina):长杆状菌,无扁平囊泡或管状胞内膜;
硝化螺菌属(Nitrospira):螺旋形菌体,无胞内膜结构。
部分菌株具有单根极生,或亚极生鞭毛(single polar/subpolar flagellum),可运动。
二、系统发育学特征
与仅分布于变形菌门(Proteobacteria)两个分支的氨氧化菌不同,亚硝酸盐氧化菌在系统发育上分布更为分散。
硝化杆菌属(Nitrobacter)属于α-变形菌纲(Alphaproteobacteria),而硝化球菌属(Nitrococcus)则归类于γ-变形菌纲(Gammaproteobacteria)。硝化刺菌属(Nitrospina)暂被划分为δ-变形菌纲(Deltaproteobacteria),但该分类仍需进一步验证。硝化螺菌属(Nitrospira)曾被认为与硝化刺菌属亲缘相近,但后续研究证实其不属于变形菌门。Ehrich等研究表明,这类亚硝酸盐氧化菌在系统发育上处于孤立位置,代表细菌域(Bacteria)中的一个新门,硝化螺菌门(Nitrospirae)。《伯杰氏系统细菌学手册》第一卷对硝化螺菌属有详细描述,本文亦提供相关数据,以便对比分析。
硝化杆菌属(Nitrobacter)包含四个已描述物种,而硝化球菌属(Nitrococcus)和硝化刺菌属(Nitrospina)目前各仅有一个已知物种。文献中记载的硝化螺菌属(Nitrospira)有两个物种,但该属实际可能具有更高的系统发育多样性。
三、生态学与分布
研究最为深入的亚硝酸盐氧化细菌是硝化杆菌属(Nitrobacter),该菌曾被认为在除海洋环境外的大多数自然环境中占据主导地位。然而,近几年的研究(尤其是分子生物学研究),显著改变了这一认知,当前的研究焦点已转向硝刺菌属(Nitrospira)的分布。截至目前,硝化球菌属(Nitrococcus)和硝化针菌属(Nitrospina)仅在海洋生境中被发现。
硝化杆菌属是土壤和淡水中的微生物,对环境条件变化具有较强的耐受性。该属成员也存在于污水和海洋环境中。其他分离株最初从极端环境中获得,例如混凝土、天然石材、沙漠土壤和硫化矿矿山。其中一株嗜酸菌(最适pH 5.5)分离自酸性森林土壤。近年来,从西伯利亚和肯尼亚的苏打湖中分离出兼性嗜碱的硝化杆菌菌株,并被描述为新物种——碱性硝化杆菌(N. alkalicus)。
尽管亚硝酸盐氧化菌不形成内生孢子,但它们能在长期饥饿和干燥条件下存活。其生存策略之一可能是合成并积累胞外相容性溶质。研究发现,硝化杆菌能合成海藻糖,并能从培养基中积累甘氨酸甜菜碱和蔗糖。在盐胁迫和干燥条件下,培养物中相容性溶质的含量可重复性增加。普通硝化杆菌(N. vulgaris)可在无水条件下存活24个月。Diab和Shilo发现,附着颗粒对硝化杆菌细胞的活性和存活均有积极作用。
通过蛋白质自动模式匹配技术,对硝化杆菌三个物种的生境特异性分布进行分析发现,普通硝化杆菌是建筑石材中的优势种。汉堡硝化杆菌(N. hamburgensis)仅存在于土壤中,而维氏硝化杆菌(N. winogradskyi)则分布于土壤、淡水、污水和混凝土等多种生境。Both等指出,在亚硝酸盐限制的富氧土壤中,维氏硝化杆菌因自养和混养条件下对亚硝酸盐的Km值更低而更具竞争力;但在低氧条件下,汉堡硝化杆菌的活性会增强。
对硝化杆菌种群的免疫学和分子生物学研究表明,该属多个菌株可共存。Navarro等通过PCR/RFLP(限制性片段长度多态性)技术对自然种群进行表征,发现不同土壤和湖泊中存在多种共存菌株,这种共存可能反映了局部生态位的分化。Grundmann和Normand基于16S-23S rRNA基因间隔区扩增片段限制性分析(ADRA)和23S rRNA基因部分序列的遗传距离,实现了土壤中硝化杆菌物种的比较。Wagner等开发了两种针对硝化杆菌16S rRNA的特异性寡核苷酸探针,用于原位分析。尽管该属曾被视为多种环境中的优势亚硝酸盐氧化菌,但在活性污泥和生物膜样本中未被检出,研究者推测这些生境中可能存在未知的硝化微生物。
这一假说近期得到验证:多项研究指出,类硝刺菌(Nitrospira-like)细菌可能是淡水水族箱、生物膜和活性污泥中的优势亚硝酸盐氧化菌。Schramm等在硝化反应器中发现两个与莫斯科硝刺菌(N. moscoviensis)系统发育相关的类群。Watson等首次从缅因湾分离出新属海洋硝刺菌(Nitrospira marina)(图1),而莫斯科硝刺菌则分离自莫斯科供暖系统。类似菌株还从土壤、沉积物、海滩沙地和盐沼中富集获得。研究表明,尽管硝刺菌属分布广泛,但在标准分离流程中易被硝化杆菌属竞争抑制。
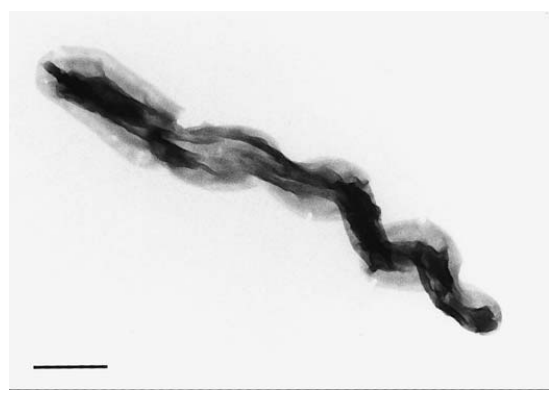
图1. 以无机自养方式培养的海洋硝化螺菌(Nitrospira marina)螺旋形细胞。醋酸铀负染色。比例尺=500纳米。
Bartosch等利用靶向亚硝酸盐氧化还原酶(NOR)的单克隆抗体研究发现,培养基底物浓度会影响活性污泥中富集的亚硝酸盐氧化菌属。当采用Watson等的混养培养基(含0.2 g/L NaNO2)时,硝刺菌属为优势菌;而NaNO2浓度升至2 g/L时,硝化杆菌属占主导。尽管污水处理厂中的硝刺菌曾被认为“不可培养”,但汉堡Dradenau的污水样本通过避免湍流的改良培养技术,成功富集出硝刺菌微菌落(图2)。目前,研究人员正对永冻土、洞穴和热泉等多种生境来源的硝刺菌培养物展开研究。
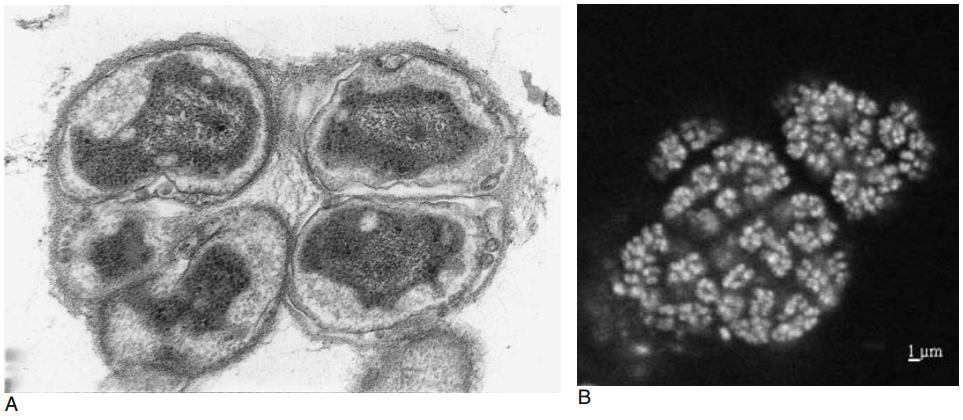
图2. 汉堡Dradenau污水处理厂活性污泥中类硝化螺菌的微菌落。 A) 活性污泥超薄切片。这些细胞在超微结构上与硝化螺菌属相似,表现为扩展的周质空间且无胞质内膜。比例尺=250纳米。 B) 亚硝酸盐氧化富集培养物的荧光原位杂交(FISH),使用针对莫斯科硝化螺菌(N. moscoviensis)的特异性寡核苷酸探针S-*Ntspa-1026-a-A-18。细胞在含0.2克/升亚硝酸钠的混养培养基中培养。图片由S. Bartosch提供。
截至目前,系统发育分析显示硝刺菌属可划分为四个亚群(基于水生环境序列),其中两个亚群包含已描述的莫斯科硝刺菌和海洋硝刺菌。第三个物种(分离自莫斯科供暖系统)即将被描述。从贝加尔湖热泉分离的一株嗜热菌通过DGGE分析显示与已知硝刺菌存在差异。随着新菌株的分离和环境样本测序的推进,硝刺菌的系统发育树将更趋复杂。
四、生长特性
亚硝酸盐氧化菌(nitrite oxidizers)的化能自养(lithotrophic)生长较为缓慢,代时(generation time)介于8小时至数天之间。其生长速率受底物(substrate)浓度、温度、pH、光照及氧气浓度调控。
大多数菌株在亚硝酸盐(nitrite)浓度为2–30 mM、pH 7.5–8.0、温度25–30℃的条件下生长最佳。
部分菌株(strains)可进行混合营养(mixotrophic)生长,其混合营养培养(mixotrophically grown cultures)的细胞产量(cell yield)可达化能自养培养(lithotrophically grown cultures)的十倍。
五、生物化学特性
目前,关于硝化细菌的生物化学研究主要集中于硝化杆菌属(Nitrobacter)。早期对硝化螺菌属(Nitrospira)的研究表明,其与硝化杆菌属存在显著差异。
而硝化球菌属(Nitrococcus)和硝化刺菌属(Nitrospina)的生化机制尚不明确。
5.1 酶系统与细胞色素特征
硝化杆菌属与硝化球菌属在细胞色素组成、亚硝酸盐氧化酶的分子质量及定位上高度相似;
而硝化刺菌属和硝螺菌属则与上述两属不同,但二者彼此间特性相近。
5.2 底物转运与关键酶
在有氧硝化过程中,底物亚硝酸盐(NO₂⁻)被认为,通过亚硝酸盐/硝酸盐逆向转运系统(nitrite/nitrate antiport)进入细菌细胞。作为逆反应的电子受体,硝酸盐(NO₃⁻)推测由同一转运蛋白介导。
亚硝酸盐氧化的关键酶:
硝化杆菌属:亚硝酸盐氧化还原酶(NOR, nitrite oxidoreductase)
硝化球菌属、硝化刺菌属和硝化螺菌属:亚硝酸盐氧化系统(NOS, nitrite-oxidizing system)
酶定位与结构:
所有亚硝酸盐氧化细菌的共同特征:细胞膜上存在密集排列的酶颗粒(membrane-bound particles),分布于细胞质膜(cytoplasmic membrane)和胞内膜(intracytoplasmic membrane)表面;免疫标记(immunolabeling)证实,这些颗粒与NOR/NOS酶的定位一致。
具体定位差异:
硝化杆菌属与硝化球菌属:NOR/NOS定位于细胞质膜与胞内膜的内侧。
硝化刺菌属与硝螺菌属(无胞内膜):NOS分布于周质空间,其中硝螺菌属的酶还附着于细胞膜外表面。这种定位可能解释二者对亚硝酸盐的敏感性高于硝化杆菌属和硝化球菌属。
分子质量差异:
硝化杆菌属的b-NOR与硝化球菌属的b-NOS均为65 KDa。
硝化刺菌属(48 KDa)与硝螺菌属(46 KDa)的b-NOS分子质量较小。
5.3 硝化杆菌属NOR的结构与功能
其NOR呈周期性双排排列。Tsien和Laudelout提出:至少需4个颗粒结合以维持酶活性,且颗粒间结构的完整性至关重要。
单个颗粒分子量为186 KDa,提示其为αβ异源二聚体。
5.4 能量代谢与电子传递链
亚硝酸盐氧化为硝酸盐释放2个电子(方程式如下),其中硝酸盐的第三个氧原子来自水:
NO₂⁻ + H₂O → NO₃⁻ + 2H⁺ + 2e⁻
2H⁺ + 2e⁻ + 0.5 O₂ → H₂O
总反应:NO₂⁻ + 0.5 O₂ → NO₃⁻
电子传递路径:
亚硝酸盐→钼蝶呤(molybdopterin)→铁硫簇→细胞色素a₁→细胞色素c→细胞色素aa₃→O₂。
关键酶:NOR(含钼蝶呤和铁硫簇)催化电子从亚硝酸盐传递至细胞色素a₁。
热力学挑战:NO₂⁻/NO₃⁻电对的氧化还原电位(E₀' = +420 mV)较高,导致细胞色素c的还原效率低。
能量供应:
硝化杆菌属在指数生长期的能量电荷(energy charge)仅为0.37。
通过高含量NOR(占总蛋白10–30%)补偿能量生成效率。
主要能量产物为NADH,用于ATP合成。
5.5 末端氧化酶的适应性
汉堡硝化杆菌(Nitrobacter hamburgensis):在亚硝酸盐氧化时使用细胞色素aa₃,而异养生长时则依赖b型细胞色素。
细胞色素分布:硝化杆菌属与硝化球菌属富含细胞色素c和a,而硝化刺菌属与硝螺菌属缺乏a型细胞色素。
5.6 碳固定途径
化能自养型亚硝酸盐氧化细菌,通过卡尔文循环(Calvin cycle)固定CO₂,约80%的能量用于此过程。
RubisCO酶:在硝化杆菌中,该酶以可溶形式或羧酶体(carboxysome)结合形式存在。
Nitrobacter winogradskyi:可溶型RubisCO分子量为480 KDa。
Nitrobacter hamburgensis X14:存在两种形式(480 KDa与520 KDa),均为L₈S₈八聚体结构,且大亚基基因分别位于染色体与质粒上。
基因定位:普通硝化杆菌(Nitrobacter vulgaris)的卡尔文循环基因成簇分布于染色体两处。
六、亚硝酸盐氧化菌的富集与分离流程
亚硝酸盐氧化菌可使用含亚硝酸盐的无机培养基进行分离,其自养型、混养型和异养型培养基的配方见表1。
富集培养物需经连续稀释后,在黑暗条件下培养1至数月。由于该类菌对高氧分压敏感,其在琼脂表面的生长受限。
通过将亚硝酸盐琼脂上的菌落多次传代至液体培养基中,可获得Nitrobacter alkalicus的纯培养物。对于Nitrospira等菌种,可采用Percoll梯度离心,结合连续稀释法去除异养菌污染。
表1. 亚硝酸盐氧化菌的三种不同培养基组成
# A 培养基:陆生菌株无机自养型;B 培养基:海洋菌株无机自养型;C 培养基:混养型;C 培养基去除NaNO₂后为异养型
| 成分 | 培养基A | 培养基B | 培养基Cc, d |
|---|---|---|---|
| 蒸馏水(毫升) | 1000 | 300 | 1000 |
| 海水(毫升) | - | 700 | - |
| 亚硝酸钠 (毫克) | 200-2000 | 69 | 200-2000 |
| 七水硫酸镁 (毫克) | 50 | 100 | 50 |
| 二水氯化钙 (毫克) | - | 6 | - |
| 碳酸钙(毫克) | 3 | - | 3 |
| 磷酸二氢钾 (毫克) | 150 | 1.7 | 150 |
| 七水硫酸亚铁 (毫克) | 0.15 | - | 0.15 |
| 螯合铁 (13%, Geigy) (毫克) | - | 1 | - |
| 二水钼酸钠 (微克) | - | 30 | - |
| 四水合七钼酸铵 (微克) | 50 | - | 50 |
| 六水氯化锰 (微克) | - | 66 | - |
| 六水氯化钴 (微克) | - | 0.6 | - |
| 五水硫酸铜 (微克) | - | 6 | - |
| 七水硫酸锌 (微克) | - | 30 | - |
| 氯化钠 (毫克) | 500 | - | 500 |
| 丙酮酸钠 (毫克) | - | - | 550 |
| 酵母提取物(Difco)(毫克) | - | - | 1,500 |
| 蛋白胨 (Difco) (毫克) | - | - | 1,500 |
| pH值调整至e | 8.6 | 6 | 7.4 |
注释:
a 适用于 Bock 等(1983 年)的陆生菌株
b 根据 Watson 和 Waterbury(1971 年)的研究修改,适用于海洋菌株
c 适用于 Bock 等(1983 年)的陆生菌株
d 异养生长培养基 C 不使用 NaNO₂
e 灭菌后 pH 值应为 7.4–7.8
七、菌种保藏方法
硝化菌在17℃的液体培养基中,可耐受饥饿状态超过一年,但仍建议每4个月转接至新鲜培养基。
表1 列出了三种适用于亚硝酸盐氧化菌的生长培养基。液氮冷冻是一种有效的长期保藏方法,菌种需悬浮于含蔗糖和组氨酸的冻存缓冲液中。
若采用熔岩棉(lavalite)或聚氨酯(polyurethane)作为载体进行冻干,约0.5%的Nitrobacter细胞可存活一年。
另一种长期保藏方法是,将Nitrobacter培养于,装满复合培养基的1L瓶中(使用甘油替代丙酮酸,以维持pH长期稳定),并密封保存。
由于该菌能好氧氧化亚硝酸盐为硝酸盐,并进一步厌氧还原硝酸盐,因此该方法可获得较高的细胞产量。
八、四大类亚硝酸盐氧化菌的鉴别特征
表2、3和4分别列出了,可用于区分四类亚硝酸盐氧化菌的形态学、基因型和化学分类学特征。
表2. 亚硝酸盐氧化细菌四个属的鉴别
| 特征 | 硝化杆菌属 (Nitrobacter) | 硝化球菌属 (Nitrococcus) | 硝化刺菌属 (Nitrospina) | 硝化螺菌属 (Nitrospira) |
|---|---|---|---|---|
| 系统分类地位 | α-变形菌纲 (Alphaproteobacteria) | γ-变形菌纲 (Gammaproteobacteria) | δ-变形菌纲 (Deltaproteobacteria) (暂定) | 硝化螺菌门 (Nitrospirae) |
| 形态学 | 多形性短杆菌 | 球形细胞 | 直杆菌 | 弯曲杆菌至螺旋状 |
| 胞内膜结构 | 极性帽结构 | 管状 | 无 | 无 |
| 细胞大小 (μm) | 0.5–0.9 × 1.0–2.0 | 1.5–1.8 | 0.3–0.5 × 1.7–6.6 | 0.2–0.4 × 0.9–2.2 |
| 运动性 | + | + | - | - |
| 繁殖方式 | 芽生或二分裂 | 二分裂 | 二分裂 | 二分裂 |
| 主要细胞色素类型a | a, c | a, c | c | b, c |
| 亚硝酸氧化系统定位 | 细胞质膜 | 细胞质膜 | 周质空间 | 周质空间 |
| MAb标记的亚单位(KDa)b | 130 和 65 | 65 | 48 | 46 |
| 膜结合颗粒的晶体结构 | 成排的颗粒二聚体 | 成行的颗粒 | 六方晶格排列 | 六方晶格排列 |
# 注释:
a 化能自养生长。 b MAbs,单克隆抗体。
表3. 亚硝酸盐氧化细菌的特性
| 特征 | 维氏硝化杆菌 (Nitrobacter winogradskyi) | 碱性硝化杆菌 (Nitrobacter alkalicus) | 汉堡硝化杆菌 (Nitrobacter hamburgensis) | 普通硝化杆菌 (Nitrobacter vulgaris) | 运动硝化球菌 (Nitrooacus mobilis) | 纤细硝化螺菌 (Nitrospina gracilis) | 海洋硝化螺菌 (Nitrospina marina) | 马氏硝化螺菌 (Nitrospina masconiensis) |
|---|---|---|---|---|---|---|---|---|
| DNA的G+C摩尔百分比 | 61.7 | 62 | 61.6 | 59.4 | 61.2 | 57.7 | 50 | 56.9 |
| 羧酶体 | + | − | + | + | + | − | − | − |
| 生境: | ||||||||
| 淡水 | + | + | ||||||
| 废水 | + | + | ||||||
| 半咸水 | + | |||||||
| 海洋 | + | + | + | + | + | |||
| 苏打湖 | ||||||||
| 土壤 | + | + | + | + | ||||
| 苏打土壤 | ||||||||
| 岩石 | + | + | ||||||
| 加热系统 | ||||||||
表4. 已描述的亚硝酸盐氧化细菌的主要脂肪酸a,b
| 脂肪酸 | Nitrobacter winogradskyi Engel | Nitrobacter alkalicus AN4 | Nitrobacter hamburgensis X14 | Nitrobacter vulgaris Z | Nitrococcus mobilis 231 | Nitrospina gracilis 3 | Nitrospira marina 295 | Nitrospira moscoviensis M1 |
|---|---|---|---|---|---|---|---|---|
| C14:1顺式-9 | + | + | + | + | ++ | + | + | + |
| C14:0 | +++ | |||||||
| C16:1顺式-7 | + | + | + | + | +++ | +++ | +++ | +++ |
| C16:1顺式-9 | + | + | + | + | +++ | +++ | +++ | +++ |
| C16:1顺式-11 | +++ | +++ | ||||||
| C16:03OH | ++ | ++ | ++ | ++ | +++ | ++ | ++ | ++ |
| C16:0 | +++ | ++ | ++ | ++ | ||||
| C16:0 11甲基 | + | + | + | +++ | ||||
| C18:1顺式-9 | ++ | ++ | ++ | ++ | +++ | + | + | + |
| C18:1顺式-11 | ++++ | ++++ | ++++ | ++++ | ++++ | ++ | + | + |
| C18:0 | + | + | + | + | + | ++ | ++ | + |
| C19:0环丙烷11-12 | + | + | + | + |
# 注释:
a 符号:+,<5%;++,6–15%;+++,16–60%;++++,>60%。
b 搅拌培养物在28°C(Nitrospira moscoviensis在37°C)下自养生长,并在指数生长期结束时收集。修改自Lipski等人。
针对亚硝酸盐氧化系统的三种单克隆抗体(MAbs)具有不同的特异性反应模式,可用于纯培养物和富集培养物的分类学研究,如Western blot和免疫荧光标记(immunofluorescent labelling)。这三种MAbs的特异性如下:
Hyb 153-2:识别Nitrobacter的α-亚硝酸盐氧化还原酶(α-NOR);
Hyb 153-1:识别Nitrobacter和Nitrococcus的β-亚硝酸盐氧化酶(β-NOS);
Hyb 153-3:与所有已知亚硝酸盐氧化菌的β-NOS反应。
由于不同菌属的β-NOS分子量存在差异,因此可通过此方法进行属间区分。
表2结果显示,Hyb 153-3所识别的β亚基表位高度保守。
这一关键酶的保守区域不支持Teske等提出的“硝化菌多次独立起源”假说(即硝化菌可能源自不同的光合作用祖先)。
MAbs的特异性反应表明,系统发育与功能之间存在紧密关联,并进一步支持Brock的观点:通过比较能量代谢相关蛋白的生物化学特性,可有效研究细菌的进化历程。
参考文献
1.Juretschko, S., G. Timmermann, M. Schmid, K.H. Schleifer, A. Pommerening-Ro¨ser, H.P. Koops and M. Wagner. 1998. Combined molecular and conventional analysis of nitrifying bacterium diversity in activated sludge: Nitrosococcus mobilis and Nitrospira-like bacteria as dominant populations. Appl. Environ. Microbiol. 64: 3042–3051.
2.Freitag, A., M. Rudert and E. Bock. 1987. Growth of Nitrobacter by dissimilatoric nitrate reduction. FEMS Microbiol. Lett. 48: 105–109.
3.Bartosch, S., I. Wolgast, E. Spieck and E. Bock. 1999. Identification of nitrite-oxidizing bacteria with monoclonal antibodies recognizing the nitrite oxidoreductase. Appl. Environ. Microbiol. 65: 4126–4133.
4.Daims, H., J.L. Nielsen, P.H. Nielsen, K.-H. Schleifer and M. Wagner.2001. In situ characterization of Nitrospira-like nitrite oxidizing bacteria active in wastewater treatment plants. Appl. Environ. Microbiol.67: 5273–5284.
5.Watson, S.W., E. Bock, F.W. Valois, J.B. Waterbury and U. Schlosser. 1986.Nitrospira marina, gen. nov. sp. nov.: a chemolithotrophic nitrite-oxidizing bacterium. Arch. Microbiol. 144: 1–7.
翻译自:Bergeys Manual of Systematic Bacteriology (Garrity, Berner, Creig) . Volume Two:The ProteobacteriaPart A Introductory Essays.(The Lithoautotrophic Nitrite-Oxidizing Bacteria)
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-08-15
编制人:思琪
审稿人:小藻
