废水处理系统微生物样品前处理通用技术规范
来源:武汉市灰藻生物科技有限公司 浏览量:861 发布时间:2024-11-26 12:43:19

前言
本标准按照GB/T1.1-2009给出的规则起草
本标准由中国石油和化学工业联合会提出。
本标准由全国化学标准化技术委员会(SAC/TC63)归口。
本标准起草单位:南京大学、南京大学宜兴环保研究院、南京江岛环境科技研究院有限公司、中海油天津化工研究设计院有限公司、蓝保(厦门)水处理科技有限公司、东莞理工学院、国网天津市电力公司电力科学研究院、石家庄给源环保科技有限公司、珠海京工检测技术有限公司。
本标准主要起草人:任洪强、何席伟、张徐祥、白莹、吕奋勇、牛军峰、苏展、耿金菊、李永广、王庆王磊、吴兵。
废水处理系统微生物样品前处理通用技术规范
1范围
本标准规定了废水处理系统中微生物样品的现场处理、微生物菌种分离与保藏、微生物样品宏基因组DNA提取以及微生物样品的保存。
本标准适用于采用生物处理工艺(活性污泥法工艺和生物膜法工艺)的废水处理系统中微生物样品的现场处理、提取与保存。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
HT91.1 污水监测技术规范
SN/T2632微生物菌种常规保藏技术规程
3术语和定义
下列术语和定义适用于本文件
3.1微生物样品microorganismsamples
已培养或已提取纯化的,可直接应用于分析研究的各种菌株(包括细菌、真菌、放线菌等)、DNA等遗传物质;以及包含上述菌株和遗传物质的废水处理系统中的进出水样品、活性污泥样品、生物膜样品等。
3.2前处理pre-treatment
在开展废水处理系统微生物研究工作之前对采集的各种微生物样品所进行的各种处理
3.3宏基因组metagenome
不经菌株分离筛选步骤,直接从环境样品中提取的遗传物质(DNA或RNA),包含了样品中所有微生物的遗传信息。
[GB/T 30744-2014,定义 3.1.6]
4缩略语
下列缩略语适用于本文件
CTAB:十六烷基三甲基溴化铵(Cetyltrimethylammonium bromide)
DNA:脱氧核糖核酸(Deoxyribonucleic acid)
EDTA:乙二胺四乙酸(Ethylenediaminetetraacetic acid)
LB:肉汤培养基(Luria-bertani)
OD:光密度(Optical density)
RNaseA:核糖核酸酶A
SDS:十二烷基硫酸钠(Sodium dodecyl sulfate)
TE:Tris-HCl和EDTA-2Na配成的缓冲液
Tris:三羟甲基氨基甲烷(2-Amino-2-hydroxymethyl-1,3-propanediol)
16SrRNA基因:细菌染色体上编码核糖体RNA16S亚基的基因
18SrRNA基因:真核生物染色体上编码核糖体RNA18S亚基的基因
5试剂或材料
5.1本标准所用试剂和水,除非另有规定,应使用分析纯试剂和电阻率大于18M·cm的超纯水
5.2无水乙醇。
5.3异丙醇。
5.4盐酸溶液:1mol/L。量取83m盐酸,缓慢加人917m水中,混匀。
5.5氢氧化钠溶液:40g/L。
5.6重铬酸钾溶液:5g/L。
5.7SDS 溶液:100 g/L。
5.8生理盐水:称取9gNaCl,溶于1L水中。混匀后在高压灭菌锅中121℃灭菌20min(简称灭菌处理)
5.9乙醇溶液:50%。
5.10乙醇溶液:75%
5.11 1/3000孟加拉红溶液(玫瑰红水溶液):称取1g孟加拉红溶解于3L水中
5.12 链霉素溶液:0.3 g/L。
5.13 Tris-HCl贮液:1mol/L。称取121.14gTris,溶解于800ml水中,用盐酸溶液调节pH值至8.0,加水稀释至1L
5.14 Tris-HCl溶液:移取10.00ml Tris-HCl贮液置于1L容量瓶中,用水稀释至刻度。
5.15DNA抽提缓冲液:称取 37.3gEDTA-2Na、17.8g磷酸氢二钠(Na HPO:·2H O)、15.6g磷酸二氢钠(NaH,PO:·2H,O)、87.8g氣化钠和10gCTAB,溶解于700ml,水中,加人100 ml Tris-HC贮液,用盐酸溶液和氢氧化钠溶液调节pH值至8.0,加水稀释至1L后灭菌处理。
5.16 TE溶液:称取0.373gEDTA-2Na,溶解于800mL水中,加人10mL Tris-HCl贮液,用氢氧化钠溶液调节pH值为8.0,加水稀释至1L后灭菌处理。
5.17 酚-氯仿-异戊醇溶液:将500ml Tris饱和酚、480mL氯仿和20ml异戊醇溶液混合均匀,贮存于棕色玻璃瓶中,4℃可保存两周。
5.18 LB培养基:称取 10g蛋白胨,5g酵母膏,10g氣化钠,18g琼脂粉溶解于1L水中,混匀后灭菌处理。
5.19 高氏一号培养基:称取 20g可溶性淀粉,1g硝酸钾,0.5g磷酸二钾,1g硫酸镁(MgSO:7H,O),0.01g硫酸亚铁,溶解于1L水中,用氢氧化钠溶液调节pH值至7.2~7.4。加入10ml重铬酸钾溶液,再加人18g琼脂粉,混后灭菌处理。
5.20 马丁氏培养基:称取 10g葡萄糖,5g蛋白胨,1g磷酸二氢钾,0.5g硫酸镁(MgSO:·7H,O),浴解于 800m!,水中,加人100ml,1/3 000孟加拉红溶液,再加人18g琼脂粉,混匀后灭菌处理。冷却至50℃~60℃时,加人100 mL链霉素溶液,混匀。
5.21 溶菌酶贮液:10g/L。称取1g溶菌酶,溶解于100mLTris-HCl溶液。于-20℃保存
5.22RNaseA贮液:10g/L。称取1gRNase A,0.09gNaCl,溶解于100ml预先用盐酸溶液调节pH值至 7.5的 Tris-HCl溶液,于100℃加热15 min,按每管1mL分装,于-20 ℃保存。
5.23无菌滤膜:直径47mm,孔径为0.22μm或0.45μm的混合纤维素酯滤膜。
5.24 离心管:材质为聚丙烯。
6仪器设备
6.1真空泵:真空度大于或等于-80kPa,空载流量大于或等于20L/min。
6.2砂芯过滤器:滤头直径为50mm,接收瓶体积为500mL~1000ml,的砂芯过滤器
6.3超低温冰箱:最低保存温度为-80℃
6.4高速冷冻离心机:配有 50 ml,离心管。温度调节范围4℃~20℃,转速0r/min~18 000 r/min。
6.5振荡培养箱:温度调节范围0℃~60℃,转速0r/min~300r/min。
6.6生化培养箱:温度调节范围0℃~60℃
6.7高压灭菌锅:温度可升至121℃,压力可维持0.1MPa~0.15 MPa。
6.8超净工作台:洁净度级别100级。
6.9恒温水浴锅:温度调节范围室温~99℃
6.10 光学显微镜:放大倍数40x~2000x。
6.11微量移液枪:100μL~1000 μL
6.12涡旋仪:转速0r/min~3000r/min。
6.13超微量紫外分光光度计:波长范围200nm~850nm。
7样品的现场处理
7.1 一般规定
7.1.1样品的现场处理包括样品的分装、固定与现场保存,样品包括水样、活性污泥样品以及生物膜样品。
7.1.2采样前应了解废水处理系统的处理工艺、废水类型和废水排放规律等情况,并按HJ91.1的规定进行采样。
7.1.3 用于分样和装样的器具均应灭菌处理,如现场条件无法实现,应用75%乙醇溶液擦拭后使用
7.2 水样的现场处理
7.2.1 用于菌种分离的水样处理
将无菌滤膜置于砂芯过滤器内,使用真空泵对水样进行抽滤。滤膜的过水量视水样的浑浊程度而定通常进水水样每张滤膜的过水量为50ml~200ml,出水水样每张滤膜过水量为500mL~1000ml;水样过滤应于2h内完成。过滤后,将滤膜放人50m离心管中,于1℃~5℃保存。
7.2.2 用于宏基因组DNA提取的水样处理
7.2.2.1按7.2.1操作将水样进行过滤处理,过滤后,将滤膜放人50ml离心管中,于-20℃保存。
7.2.2.2若水样不能进行现场过滤,应将水样置于1℃~5℃保存,并于24h内带回实验室进行过滤处理。
7.3 活性污泥样品的现场处理
7.3.1 用于镜检或菌种分离的活性污泥样品处理
将采集的泥水混合物静置5min~15min至泥水产生明显分层,弃去上层清液,将下层活性污泥装人50 m离心管中,于1℃~5 ℃保存。
7.3.2 用于宏基因组 DNA 提取的活性污泥样品处理
7.3.2.1 将采集的泥水混合物静置5min~15 min至泥水产生明显分层,弃去上层清液,将下层活性污泥装人50m离心管中,于-20℃保存。
7.3.2.2 若现场无法进行-20℃保存,可在装有活性污泥的离心管中加入等体积的无水乙醇进行固定后于1℃~5 ℃保存。
7.4 生物膜样品的现场处理
7.4.1 用于镜检或菌种分离的生物膜样品处理
7.4.1.1 用铲子或刀片等工具将生物膜从反应器内的填料(主要见于移动床生物膜反应器工艺、生物接触氧化工艺、生物滤池工艺等)、生物转盘(主要见于生物转盘工艺)或滤膜(主要见于膜生物反应器工艺)表面刮下,装人50m离心管中,于1℃~5 ℃保存。7.4.1.2 对于难以刮取的填料附着型生物膜样品,直接采集其附着的部分填料装人聚丙烯采样瓶中(采样瓶规格可视填料尺寸而定),于1℃~5℃保存。
7.4.2 用于宏基因组 DNA 提取的生物膜样品处理
7.4.2.1 用铲子或刀片等工具将生物膜从反应器内的填料、生物转盘或滤膜表面刮下,装人50ml,离心管中,于-20℃保存。
7.4.2.2 对于难以刮取的填料附着型生物膜样品,直接采集其附着的部分填料装入聚丙烯采样瓶中(采样瓶规格可视填料尺寸而定),于-20℃保存。7.4.2.3 若现场无法进行-20℃保存,可在装有生物膜的离心管或装有填料的采样瓶中加人 50%乙醇溶液,将生物膜或填料浸没、固定,于1℃~5℃保存。
7.5数据记录
将采样时间、地点、样品类型、工艺类型、采样方式、处理方式、样品体积、保存方式等参数记录于废水处理系统微生物样品现场处理记录表(参见附录A中表A.1)。
8菌种分离与保藏
8.1一般规定
8.1.1 菌种分离是指从所采集的水样、活性污泥以及生物膜样品中分离微生物菌株,包括细菌、放线菌、真菌。
8.1.2 进行微生物菌种分离应选用1℃~5℃保存的未经固定的样品。
8.1.3 菌种分离与保藏工作应在无菌条件下进行,所用的离心管、枪头、配制的溶液均应灭菌处理,冷却后使用。
8.1.4 细菌的分离筛选采用1B培养基;放线菌的分离筛选采用高氏一号培养基;真菌的分离筛选采用马丁氏培养基。
8.2微生物的分离培养
8.2.1 分离培养样品前处理
8.2.1.1 含菌滤膜的前处理:取经7.2.1处理而得的含菌滤膜一张,在超净工作台中剪碎装人50ml离心管中,加入 20ml,生理盐水使其浸没,在涡旋仪上振荡1min制成菌悬液,除去滤膜,取10ml菌悬液待用。
8.2.1.2 活性污泥的前处理:取1ml,经7.3.1处理而得的活性污泥,用生理盐水稀释到10mL,在涡旋仪上振荡30s使其混匀后待用。
8.2.1.3 生物膜的前处理:对于从填料或生物转盘上刮下的生物膜,取1mL,经7.4.1.1处理而得的生物膜,用生理盐水稀释到10mL,在涡旋仪上振荡30s使其混匀后待用。对于附着于填料上的生物膜,取10g经7.4.1.2处理而得的填料放入三角瓶中(三角瓶体积视填料尺寸而定),加入生理盐水使其浸没,在250r/min的振荡培养箱振荡2min制成菌悬液,取10m菌悬液待用。
8.2.2菌种的分离
8.2.2.1 取1ml,8.2.1制得的菌悬液,用生理盐水稀释到10ml,制成10一'样品稀释液,振荡均匀。
8.2.2.2取1ml,8.2.2.1制得的菌悬液,用生理盐水稀释到10m!,制成10-样品稀释液,振荡均匀。
8.2.2.3按上述步骤依次稀释成10-3~10-9的样品稀释液,振荡均匀。
8.2.2.4 取各梯度样品稀释液100μL,分别涂布于培养基平板上,LB培养基37℃倒置培养2d~3d,高氏一号培养基 28 ℃倒置培养3d~5d,马丁氏培养基28 ℃倒置培养5d~7d,观察菌落生长情况
8.2.2.5将长出的单菌落分别转接到新的相同培养基平板上,并做好相应的记号,于相同温度下继续培养。
8.2.2.6将平板上长出的单菌落多次划线分离培养,根据平板上的菌落形态和颜色,辅以镜检检测,直至获得纯的单菌落。
8.2.2.7 对获得的单菌落,通过比较细菌和放线菌的16SrRNA基因序列,或真菌的18SrRNA基因序列,进行菌种鉴定,排除重复的菌株。
8.3菌种保藏
按照SN/T2632操作
8.4数据记录
将所分离的菌株来源、种属、培养条件、保存方式等相关参数记录于废水处理系统微生物分离鉴定记录表(参见表A.2)。
9微生物样品宏基因组 DNA 提取与保存
9.1一般规定
9.1.1进行宏基因组DNA提取应选用-20℃保存的样品,或经乙醇固定的样品
9.1.2宏基因组 DNA提取过程中,所用的离心管、枪头、配制的溶液均应灭菌处理,冷却后使用。
9.1.3用超微量分光光度计测定DNA溶液的浓度和纯度,宏基因组DNA应达到的质量标准为:OD:/OD,的比值在1.8~2.0之间,且OD,/OD,的比值大于 2.0。
9.2 宏基因组 DNA 提取样品前处理
9.2.1 含菌滤膜前处理:取经7.2.2处理而得的含菌滤膜二至四张,在超净工作台用灭菌剪刀将含菌滤膜剪成碎片,浸泡于装有生理盐水的50mL离心管中,充分振荡制成菌悬液,除去滤膜,菌悬液经8000r/min离心分离10min后弃去上层清液,沉淀用于宏基因组DNA提取。
9.2.2 活性污泥前处理:将经7.3.2处理的活性污泥于8000r/min下离心分离2min,弃去上层清液,沉淀用于宏基因组 DNA提取。
9.2.3 生物膜前处理:对于从填料或生物转盘上刮下的生物膜,若经过固定,则将混合物于8000r/min下离心分离10min,弃去上层清液,沉淀用于宏基因组DNA提取,未经固定的生物膜可直接用于宏基因组 DNA提取;对于填料附着型生物膜,将填料浸泡于装有生理盐水的三角瓶中,振荡制成菌悬液,于8000r/min下离心分离10min后弃去上层清液,沉淀用于宏基因组DNA提取。
9.3 宏基因组 DNA 提取
9.3.1 向经 9.2处理的样品中加人5mLDNA抽提缓冲液,混匀,在振荡培养箱中于37℃,200r/min条件下振荡30min。
9.3.2 加人1mlTE溶液和0.5ml溶菌酶贮液,继续振荡30min,加入0.5mLSDS溶液,于65℃水浴30min后,6000r/min离心分离10min,将上层清液转移至新的离心管中。
9.3.3 向沉淀中加人5mLDNA抽提缓冲液和0.5mlSDS溶液,于65℃水浴10 min,6000 r/min下离心分离10min,将上层清液与9.3.2中的上清液合并于同一离心管中。
9.3.4 重复9.3.3步骤,将上层清液与9.3.2中的上清液合并于同一离心管中。
9.3.5 测量合并后的上层清液体积,加人RNaseA贮液至其终浓度为200g/mL,于37℃水浴15 min。
9.3.6 加入等体积的酚-氯仿-异戊醇溶液,轻轻摇匀,13000r/min下离心分离15min,将上层水相移人新的离心管中,加人等体积的异丙醇,于-20℃中沉淀1h后,于4℃下13000r/min 离心分离10min,弃去上层清液。
9.3.7 向沉淀中加入 200μ,无水乙醇,放置3s~5s后弃去无水乙醇,再重复一次,然后将沉淀物放置于超净工作台中吹干,加人50μLTE溶液溶解沉淀物,即为DNA溶液。注1:宏基因组DNA也可采用商用试剂盒进行提取。注2:若提取的DNA质量达不到9.1.3中的要求,可采用商用试剂盒进行纯化,或重新提取
9.4微生物样品保存
9.4.1水样按7.2.2或9.2.1处理后,将含菌滤膜或沉淀于-20℃或-80℃保存。9.4.2活性污泥和生物膜样品分别按9.2.2和9.2.3处理后,于-20℃或-80℃保存。9.4.3DNA样品保存前应分装多份,于-20℃或-80℃保存,避免反复冻融
9.5数据记录
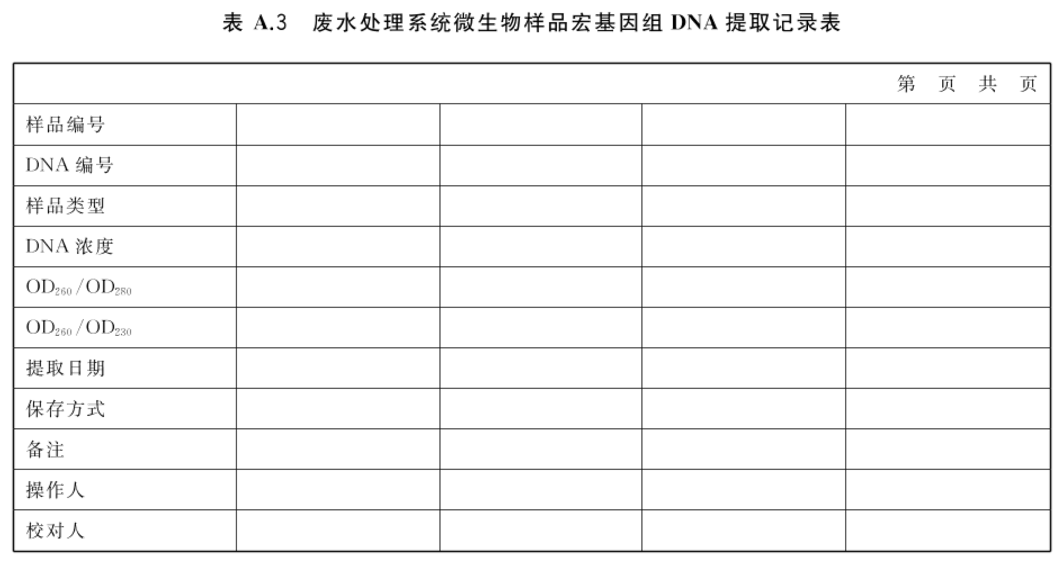
将所提取的微生物样品种类、DNA浓度、纯度、保存方式等相关参数记录于废水处理系统微生物样品宏基因组DNA记录表(参见表A.3)。
附录A(资料性附录)废水处理系统微生物样品前处理记录表
表A.1~表A.3给出了废水处理系统微生物样品现场处理、菌种分离、宏基因组DNA提取记录表格式。

参考文献
[1]GB/T 30744-2014深海微生物样品前处理技术规范
[2]GB/T 39303-2020 废水处理系统微生物样品前处理通用技术规范
相关资源
名称:沼泽红假单胞菌|Rhodopseudomonas palustris
菌株编号:HZB119728
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2024-11-26
#创作团队
编制人:木木
