GB/T 5750.12-2023微生物指标-8.2 滤膜浓缩/密度梯度分离荧光抗体法
来源:武汉市灰藻生物科技有限公司 浏览量:1273 发布时间:2024-10-17 10:13:53

8.2 滤膜浓缩/密度梯度分离荧光抗体法
8.2.1 原理
首先通过微孔滤膜法过滤水样浓缩样品或加人氯化钙溶液和碳酸氢钠溶液形成碳酸钙沉淀浓缩样品,将浓缩后的样品通过密度梯度离心进行分离纯化,然后将纯化后的样品经免疫荧光染色,通过荧光显微镜对贾第鞭毛虫孢囊进行定性分析和定量检测。具有高、高有机质和高絮凝剂含量的水源水样本应先进行前期处理。
8.2.2 培养基与试剂
8.2.2.1 纯水,GB/T6682,一级。
8.2.2.2 丙酮[(φCH3COCH3)≥99.5%]
8.2.2.3 乙醇[φ(C2H5OH)=75%]:乙醇[φ(C2H5OH=75%]或通过将75 ml,无水乙醇用纯水稀释至100mL配制获得。
8.2.2.4 Pereoll-蔗糖溶液:称取17.1g蔗糖溶解于45ml,纯水中,加入45ml,的Percoll,然后加入纯水至 100ml,混匀。此溶液的密度在1.10g/cm3~1.15g/cm3之间。于0℃~4℃冷藏保存条件下可使用7d。
8.2.2.5 磷酸盐缓冲液(PBS):分别称取8.0g氣化钠、2.9g十二水合磷酸氢二钠(Na2HPO4:12H2O)、0.2g氣化钾、0.2g磷酸二氢钾,用纯水溶解至1000mL。用1mol/L,盐酸溶液或氢氧化钠溶液调节pH值至7.2~7.4之间。于0℃~4℃冷藏保存条件下可使用7d。
8.2.2.6 磷酸盐吐温缓冲液(PBST):向100mI,PBS中加人0.01ml吐温-80,混匀。室温条件下可储存使用 30 d。
8.2.2.7 DABCO-甘油:称取12.6g甘油,边搅拌加热至60℃~70℃,然后加人0.2g的1,4-二偶氮双环(2,2,2)辛烷(DABCO),搅拌溶解。室温条件下可储存使用12个月。
8.2.2.8 牛血清蛋白(BSA)溶液[ρ(BSA)=1.0g/L]:称取0.1g牛血清蛋白(BSA)溶解于100ml,纯水中,用0.45μm滤膜过滤备用。于0℃~4℃冷藏保存,可使用1个月。
8.2.2.9 DAPI染色液:称取2mg的DAPI溶解于1mL甲醇中,作为DAPI储备液,于-20℃避光保存可使用1年。使用时,取1L的DAPI储备液加人到5ml的PBS中,混匀后得到DAPI染色液,于0℃~4℃冷藏避光保存并在当日使用。
8.2.2.10免疫荧光试剂:抗贾第鞭毛虫单克隆抗体-异硫氰荧光素试剂盒。于0℃~4℃冷藏保存。
8.2.2.11 脱水剂 30:向 30ml,无水乙醇中加入5ml的甘油,然后用纯水定容到100mL。于0℃~4℃冷藏保存可使用1年。
8.2.2.12脱水剂70:向70ml,无水乙醇中加入5mL,的甘油,然后用纯水定容到100ml。于0℃~4℃冷藏保存可使用1年。
8.2.2.13 脱水剂90:向90ml无水乙醇中加入5mL的甘油,然后用纯水定容到100mL。于0℃~4℃冷藏保存可使用1年。
8.2.2.14 贾第鞭毛虫孢囊:每份溶液中含100个贾第鞭毛虫孢囊。于0℃~4℃冷藏保存,使用前通过免疫荧光染色确认其浓度。
8.2.2.15氯化钙溶液[c(CaCl2)=1.0 mol/1,:称取 111.0g氣化钙,用纯水溶解,稀释至1000ml。
8.2.2.16碳酸氢钠溶液[c(NaHCO3)=1.0mol/L]:称取84.0g碳酸氢钠,用纯水溶解,稀释至1000 ml
8.2.2.17 氢氧化钠溶液[c(NaOH)=10 mol/L]:称取 40.0g氣氧化钠,用纯水溶解,稀释至100 ml。
8.2.2.18氨基磺酸溶液[ρ(NH2SO3H)=97.0g/L]:称取97.0g氨基磺酸,用纯水溶解,稀释至1000 ml。
8.2.3 仪器设备
8.2.3.1 富集过滤装置:配置蠕动泵(最大频率600r/min)和硅胶管的不锈钢过滤器(直径142mm)或同等功能的一体化过滤装置。
8.2.3.2 离心机:可离心15ml,锥形离心管和500mL,离心杯,离心力可达到2000g,可进行刹车挡位选择。
8.2.3.3 pH计。
8.2.3.4 磁力搅拌器:搅拌容量涌盖10L
8.2.3.5真空抽滤器
8.2.3.6涡旋振荡器。
8.2.3.7真空泵:压力可调范围为0mmHg~5mmHg。
8.2.3.8显微镜:荧光装置和微分干涉装置。450nm~480nm蓝色滤光片:330nm~385nm紫外滤光片;20倍、40倍、100倍物镜。
8.2.3.9采样桶:10L、50L。材质为聚乙烯,
8.2.3.10平底桶:10L,材质为聚丙烯。
8.2.3.11无齿镊子。
8.2.3.12密度计:量程涵盖1.10g/cm'~1.15g/cm°。
8.2.3.13免疫组化笔。
8.2.3.14电子天平。
8.2.3.15烧杯:100mL和1000 ml。
8.2.3.16容量瓶:1mL、10mL、100m和1000 mL
8.2.3.17混合纤维素酯微孔滤膜:孔径1μm,直径142mm。
8.2.3.18 醋酸纤维微孔滤膜:孔径3m,直径25 mm。
8.2.3.19载玻片。
8.2.3.20盖玻片。
8.2.3.21锥形底离心管:15mL、50m。材质为聚丙烯
8.2.3.22离心杯:500mL。
8.2.3.23巴斯德玻璃吸管。
8.2.4 试验步骤
8.2.4.1 采样
8.2.4.1.1根据水样类型不同,采集不同体积水样:水源水宜采集10L,生活饮用水宜采集50L
8.2.4.1.2样品采集后若不能立即处理,可于1℃~10℃冷藏保存,在72h内进行浓缩处理
8.2.4.2 样品浓缩
8.2.4.2.1 微孔滤膜过滤法(适用于浑浊度小于 20 NTU 的水样)
8.2.4.2.1.1 将不锈钢过滤器通过软管经蠕动泵和水样相连。将混合纤维素酯微孔滤膜正面向上置于过滤装置上,用纯水淋洗滤膜使滤膜与滤器间无气泡,安装好过滤器。打开蠕动泵过滤水样。若过滤压力过大(流速低于 0.3L/min时),可更换新的滤膜重复上述步骤。水样过滤完之后,依次用约200ml的PBST、75%乙醇和纯水清洗采样桶,并将清洗液过滤。过滤结束后,打开过滤装置,使用平头镊子将滤膜正面向内多次对折,将折叠好的滤膜置于50ml,的锥形底离心管中。若使用多张滤膜,可放置于同-50 ml锥形底离心管中。
注:蠕动泵转速设置推荐300r/min~600r/min,在此条件下水样流速为0.3L/min~2 l/min
8.2.4.2.1.2向上述50mL,锥形底离心管中加人丙酮至40m1,摇晃混匀使滤膜完全溶解。将溶解液分装进4个15 ml离心管中,在1050g条件下离心10min(勿用制动器,减速度为0)。离心结束后,用吸管吸去上清液,留下沉淀物。再次向50ml锥形底离心管中加人40mL,丙酮进行混匀,混合液分装至上述4个15 ml,离心管中,混匀后在1050g、20℃条件下离心10min(勿用制动器,减速度为0)。离心结束后,用吸管吸去上清液至盛水的烧杯中,检查上清液是否因含混合纤维素酯滤膜而遇水后生成白色絮体。如有,再次向有白色絮体的15ml离心管中添加丙酮并离心去上清液,直至上清液遇水无白色絮体生成。
8.2.4.2.1.3 向上述4个15 ml,离心管离心后的沉淀物中分别加人 1.25 ml,75%乙醇,轻轻混匀,再缓慢加人PBS至10mL。2000g、20℃条件下离心10min(勿用制动器,减速度为0)。离心后吸去上清液,保留沉淀物。记录4个15ml离心管中沉淀物的总体积为V。
8.2.4.2.1.4 若沉淀物总体积V小于或等于2mL,向上述4个15ml,离心管浓缩后的沉淀物中各加入2.5mL的PBST,置于涡旋振荡器上振荡1min混匀。并且记录该样品的V1 =V。
8.2.4.2.1.5若沉淀物总体积V大于2ml,向上述4个15ml,离心管浓缩后的沉淀物中需各加人的PBST体积为1.25倍的V。置于涡旋振荡器上振荡1min混匀。将4个15ml离心管中的混合液分装至多个15 m1,离心管,保证每个离心管内样品体积不超过3ml。该样品用于后续分离纯化和染色镜检的离心管数量最好大于或等于4个,V,为用于后续分离纯化和染色镜检的液体体积的1/6。
8.2.4.2.2 碳酸钙沉淀法(适用于浑浊度大于或等于 20 NTU 的水样)
8.2.4.2.2.1 将水样转入10L平底桶,置于磁力搅拌器上,边搅拌边加入100ml氣化钙溶液,待混匀后边搅拌边加人100m碳酸氢钠溶液。
8.2.4.2.2.2用氧化钠溶液调节pH至10,静置12h~16h后使用软管通过虹吸效应吸去上清液,余下约200m沉淀物。
8.2.4.2.2.3 加人200ml,的氨基磺酸溶液溶解余下的沉淀物,转移至500mL离心杯中,用少量PBST分次洗涤平底桶,将洗涤液均加人上述500mL离心杯中。在2000g、20℃条件下离心10min(勿用制动器,减速度为0),弃去上清液,留下沉淀物。
8.2.4.2.2.4 向离心杯中加入约15 mI,PBST,播匀后平均分配至4个15 ml,离心管中,再用15 mlPBST分3次洗涤离心杯,均分别转移至上述15ml离心管中。在2000g、20℃条件下离心10min(勿用制动器,减速度为0),吸去上清液,保留沉淀物。向上述各15ml离心管的沉淀物中添加PBS至10ml,混匀,在2000g、20℃条件下离心10min(勿用制动器,减速度为0),吸去上清液,保留沉淀物。记录4个15m离心管中沉淀物的总体积为V。
8.2.4.2.2.5若沉淀物总体积V小于或等于2ml,向上述浓缩后的沉淀物中各加人2.5mL的PBST. 置于涡旋振荡器上振荡1min混匀。并且记录V1=V。
8.2.4.2.2.6 若沉淀物总体积V大于2ml,向上述4个15mL离心管浓缩后的沉淀物中需各加人的PBST体积为1.25倍的V。置于涡旋振荡器上振荡1min混匀。将4个15mL离心管中的混合液分装至多个15ml离心管,保证每个离心管内样品体积不超过3ml。该样品用于后续分离纯化和染色镜检的离心管数量最好大于或等于4个,V1为实际用于后续分离纯化和染色镜检的液体体积的1/6。
8.2.4.2.2.7 水样量大于10L时,根据水样体积重复步骤8.2.4.2.2.1~8.2.4.2.2.4,并根据15mL离心管中沉淀物的体积选择步骤8.2.4.2.2.5或者8.2.4.2.2.6进行沉淀物重悬。
8.2.4.3 分离纯化
将每个15ml离心管内溶液混匀,然后用巴斯德玻璃吸管从溶液底部缓慢加人5mlPercol-蔗糖溶液,加人过程中避免搅混两种溶液。在1050g、20℃条件下离心10min(勿用制动器,减速度为0)离心结束后,用塑料吸管取中间层(从中间层上部吸取)富含孢囊的混合液于新的15ml,离心管中。同一个样品的孢囊混合液可放置于同一离心管中。向离心后的沉淀物中添加2.5mL的PBST,混匀。再次从溶液底部缓慢加人5mlPercoll-蔗糖溶液按照上述步骤进行二次分离纯化,纯化后取中间层混合液。与上述混合液合并
8.2.4.4 染色
8.2.4.4.1 用免疫组化笔在醋酸纤维滤膜的外周画圆圈,再用镊子将滤膜平移至纯水液面上使其反面湿润。操作时滤膜不要浸人液面。
8.2.4.4.2 将上述醋酸纤维滤膜用平头镊子平移至真空抽滤器上,用吸管吸取上述混合液逐滴加到圆圈内进行抽滤。滴加时避免将混合液溅到圆圈外。抽滤过程中,滤膜上要保持有一薄层液面,以防止滤膜干燥后破损。抽滤液体后,用3mLPBS淋洗15mL离心管,淋洗液用上述方法抽滤。抽滤液体后。在滤膜圆圈内滴加0.50mLBSA溶液,保持2min,若圆圈内仍有明显液体残留则继续抽滤。
8.2.4.4.3 用镊子将滤膜平移至载玻片上,在滤膜圆圈内滴加一滴免疫荧光试剂。将载玻片置于潮湿暗环境中,在室温条件下避光静置 30min。再向滤膜圆圈内滴加0.10mL,DAPI染色溶液,室温条件下避光静置10 min。
8.2.4.4.4 用镊子将滤膜平移至真空抽滤器上进行抽滤,在滤膜圆圈内滴加4mLPBS进行淋洗。抽滤液体后,依次向圆圈内滴加各3mL的脱水剂30、脱水剂70和脱水剂90进行抽滤。
8.2.4.4.5于新的载玻片上滴加1滴DABCO-甘油,用镊子将上述滤膜平行移到有DABCO-甘油的载玻片上。再在滤膜圆圈内滴加一滴DABCO-甘油,盖上盖玻片(不要有气泡)并进行固定。于0℃~4℃冷藏避光保存,保存期为7d。
8.2.4.5镜检
应符合8.1.4.4的要求。对滤膜圆圈内全部样品进行计数
8.2.5试验数据处理
8.2.5.1 按公式(7)报告每10升样本中的孢囊数(个):

8.2.5.2按公式(8)计算分析相对标准偏差:
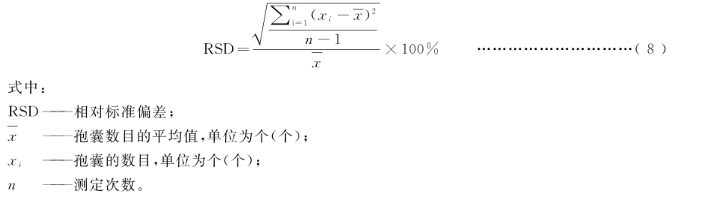
8.2.6质量控制
8.2.6.1 免疫荧光试剂盒的质量控制
8.2.6.1.1 免疫荧光试剂盒的质量控制组成
免疫荧光试剂盒的质量控制由阴性对照和阳性对照两个试验组成。样品分析时,每周进行一次。
8.2.6.1.2 阴性对照
取50LPBS作为样品按照8.2.4.4进行染色,然后镜检,检测结果不应有任何贾第鞭毛虫孢囊的检出。
8.2.6.1.3 阳性对照
取10L,免疫荧光试剂盒中阳性控制样品滴于滤膜上直接染色,在显微镜下观察,荧光镜检时,保证至少50%孢囊外形完好、未受损伤,孢的形态符合表7中描述的特征。
8.2.6.2 试验全程的质量控制
8.2.6.2.1 试验全程的质量控制组成
试验全程的质量控制是对从采样到镜检的全过程进行质量控制,由阴性对照和阳性对照两个试验组成。样品分析时,每批水样检测前进行一次。
8.2.6.2.2 阴性对照
用10L纯水作为空白,进行浓缩、分离纯化和染色后做镜检分析,若未检出任何孢囊,表明试验中未带进污染,可以进行后续操作。
8.2.6.2.3 阳性对照
为确保准确计算阳性对照的回收率,在每次阳性对照试验前对使用的已知浓度的原虫接种液进行质量控制,因此阳性对照分为原虫接种液的质量控制和阳性对照分析两部分内容。
8.2.6.2.3.1 原虫接种液样品的质量控制
按以下步骤进行。
a)直接购买的已知数量的接种液。遵循说明书进行保存并在保质期内使用。对同批次样品,使用前通过染色镜检确认孢囊数目。
b)通过流式分选获得的已知孢囊数目的样品。进行染色镜检,统计孢囊数目。该试验进行5次,计算平均浓度和标准差。如果标准差小于25%,那么以此平均浓度值为该批原虫接种液的浓度。如果标准差大于25%,重新准备样品并进行质量控制。
c)通过稀释获得的原虫接种液:涡旋2min存储的原虫,在一个有10ml,纯水的烧杯中加一些孢囊,以便得到一个最终浓度大约每毫升5X10'个孢囊的溶液,用磁棒搅拌30min。用血球计数器测定这种溶液的浓度10次,通过染色镜检测定这种溶液的浓度5次。计数这两种方法的浓度和标准差。如果标准差小于25%,那么就可以把这个读数看作是正确的。如果标准差大于25%,就要制备新的原虫接种液,然后再测定它的浓度。
注1:根据实际情况选择其中一种方式进行质量控制。
注2:按公式(9)计算平均值:
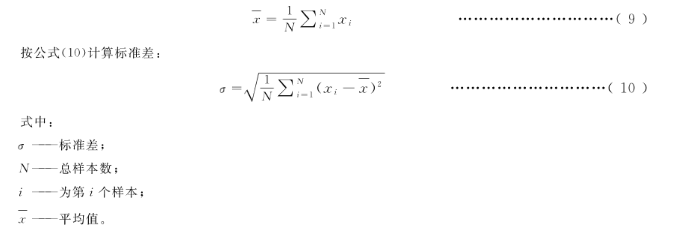
8.2.6.2.3.2 阳性对照分析
在10L纯水样品中加100个~500个贾第鞭毛虫孢囊,依次进行浓缩、分离纯化、染色和镜检,计算其回收率。在每批水样检测之前进行一次阳性对照试验。此方法的回收率在20%~100%之间。如不在此范围,需检查所有设备和试剂后重做阳性对照试验。
参考文献
《GB/T 5750.12-2023 生活饮用水标准检验方法 第12部分:微生物指标》
相关资源
名称:大肠杆菌|Escherichia coli
菌株编号:HZB133838
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2024-10-17
#创作团队
编制人:木木
