DNA片段的电泳分析技术:琼脂糖凝胶电泳原理与操作指南
来源:武汉市灰藻生物科技有限公司 浏览量:4489 发布时间:2024-06-06 13:23:13
DNA片段的分离与鉴定是现代分子生物学研究的核心技术之一,其中琼脂糖和聚丙烯酰胺凝胶电泳作为经典且广泛应用的方法,为遗传学、基因工程及疾病诊断等领域提供了强大的工具。本文档旨在详尽介绍该电泳技术的基本原理、操作流程、关键参数调控以及实验材料与设备要求,旨在提供一个清晰、实用的电泳实验指导框架。通过本指南,读者将能够理解如何根据不同DNA片段大小选择合适的凝胶类型和浓度,掌握从凝胶配制到结果分析的全过程,并认识到实验中需注意的安全事项,从而高效地进行DNA片段的分离与鉴定。
琼脂糖和聚丙烯酰胺可以制成各种形状、大小和孔隙度。琼脂糖凝胶分离DNA片段的范围较广,不同浓度的琼脂糖凝胶可分离长度从200bp至近50kb的DNA片段。琼脂糖通常用水平装置在强度和方向恒定的电场下电泳。聚丙烯酰胺分离小片段DNA(5~500bp)效果较好,其分辨力极高,甚至相差1bp的DNA片段就能分开。聚丙烯酰胺凝胶电泳很快,可容纳相对大量的DNA,但制备和操作比琼脂糖凝胶困难。聚丙烯酰胺凝胶采用垂直装置进行电泳。目前,一般实验室多用琼脂糖水平平板凝胶电泳装置进行 DNA 电泳。
琼脂糖主要在DNA制备电泳中作为一种固体支持基质,其密度取决于琼脂糖的浓度。在电场中,在中性pH下带负电荷的DNA向阳极迁移,其迁移率由下列多种因素决定。
1、DNA 的分子大小
线状双链DNA分子在一定浓度的琼脂糖凝胶中的迁移率与DNA分子质量的对数成反比,分子越大则所受阻力越大,也越难于在凝胶孔隙中蠕行,因而迁移得越慢。
2、琼脂糖浓度
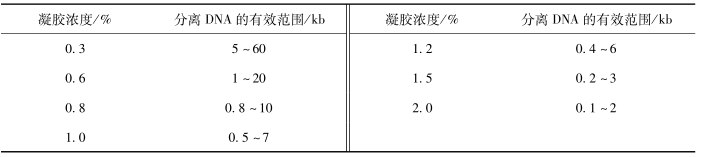
一个特定的线状DNA分子,其迁移率在不同浓度的琼脂糖凝胶中各不相同。DNA电泳迁移率的对数与凝胶浓度成线性关系。凝胶浓度的选择取决于DNA分子的大小,分离小于0.5kb的DNA片段所需胶浓度是1.2%~1.5%,分离大于10kb的DNA 分子所需胶浓度为0.3%~0.7%,DNA片段介于两者之间则所需胶浓度为0.8%~1.0%。
3、DNA 分子的构象
DNA分子在电场中的移动速度不仅和分子量有关,还和它本身的构象有关。相同分子量的线状、开环和超螺旋DNA在琼脂糖凝胶中的移动速度是不一样的,超螺旋DNA移动最快,而开环DNA移动最慢。如在电泳鉴定质粒纯度时,发现凝胶上有数条DNA带,难以确定是质粒DNA不同构象引起,还是因为含有其他DNA引起时,可从琼脂糖凝胶上将DNA带逐个回收,用同一种限制性内切酶分别水解,然后电泳,如在凝胶上出现相同的 DNA图谱,则为同一种DNA。
4、电源电压
在低电压时,线状DNA片段的迁移速率与所加电压成正比。但是随着电场强度的增加,不同分子量的DNA片段的迁移率将以不同的幅度增长,片段越大,因场强升高引起的迁移率升高幅度也越大,因此电压增加,琼脂糖凝胶的有效分离范围将缩小。要使大于2kb的DNA片段的分辨率达到最大,所加电压不得超过5V/cm。
5、嵌入染料的存在
荧光染料溴化乙锭用于检测琼脂糖凝胶中的DNA,染料会嵌入到堆积的碱基对之间并拉长线状和带缺口的环状DNA,使其刚性更强,还会使线状DNA迁移率降低 15%。
6、离子强度影响
电泳缓冲液的组成及其离子强度影响DNA的电泳迁移率。在没有离子存在时(如误用蒸馏水配制凝胶),电导率最小,DNA几乎不移动;在高离子强度的缓冲液中(如误加10x电泳缓冲液),则电导很高并明显产热,严重时会引起凝胶熔化或DNA变性。
对于天然的双链 DNA,常用的几种电泳缓冲液有TAE[含EDTA(pH8.0)和 Tris-乙酸]、TBE(Tris-硼酸和EDTA)、TPE(Tris-磷酸和EDTA),一般配制成浓缩母液,储于室温。
一、实验材料
(1)TAE电泳缓冲液 TAE(50x)储存液:242gTris,57.1mL 冰乙酸,100ml0.5mol/L EDTA(pH8.0),定容至1000mL。使用液为 TAE(1x)。
(2)6xDNA上样缓冲液30mmol/L EDTA,36%甘油,0.05%二甲苯腈蓝FF,0.05% 溴酚蓝。
(3)溴化乙锭 配成10mg/mL溶液,双蒸水配制,避光保存,用时以1:20000稀释。溴化乙锭为致癌剂,配制时防止皮肤接触。
二、实验仪器
DYY-Ⅲ 型稳压稳流电泳仪、水平电泳槽、微波炉、离心机、凝胶成像系统。
三、操作步骤
(1)0.8%琼脂凝胶板的配制 取0.8g琼脂糖加100mL TAE(1x),微波炉加热融化,将其冷却至55~65℃,倒入制胶槽中。
(2)充分凝固后从制胶槽中卸下凝胶板,放入电泳槽,加入TAE(1x),使其液面略高于琼脂糖板。
(3)DNA样品5μL加1μL6xDNA上样缓冲液,混匀后全部加样于琼脂糖板的样品孔中。
(4)稳压电泳100V约30min,使溴酚蓝指示剂泳动至适当位置。
(5)取出凝胶板,置溴化乙锭溶液中染色20min。
(6)在凝胶成像仪观察结果。
四、技术要点
(1)选择琼脂糖凝胶浓度取决于所鉴定DNA的大小,小片段DNA应用高浓度凝胶,大片段则用低浓度凝胶。在1%的琼脂糖凝胶中溴酚蓝的泳动速度与50bp的双链线状 DNA 一致。不同浓度琼脂糖凝胶及其可分离的线性 DNA大小范围见表1。
表1、不同浓度琼脂糖凝胶及其分离线性 DNA 分子的有效范围
(2)电泳中注意防止凝胶发热。
(3)将电泳仪置稳压挡,电压设置小于5V/cm(电极间的最小路径)。随着电压的增加,琼脂糖凝胶的有效分离范围缩小。
(4)溴化乙锭有强烈的致癌作用,操作时注意防护。
(5)当用低浓度的荧光嵌入染料溴化乙锭染色,在紫外光下至少可以检出1~10ng的 DNA条带,从而可以确定 DNA片段在凝胶中的位置。
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2024-06-06
#创作团队
编制人:冬冬
