基因组DNA提取技术手册:微生物的全面指南
来源:武汉市灰藻生物科技有限公司 浏览量:1507 发布时间:2024-05-14 18:59:27
引言
基因组DNA不仅可以在动植物组织中取得,还可以从微生物中进行提取。本文系统地介绍了针对微生物的基因组DNA提取方案,并以丝状真菌和酵母为例,展示特殊生物体的DNA提取流程,包括详细的实验材料、设备、试剂、操作步骤以及后期的DNA检测方法,旨在为科研人员提供一套全面且实用的指南。
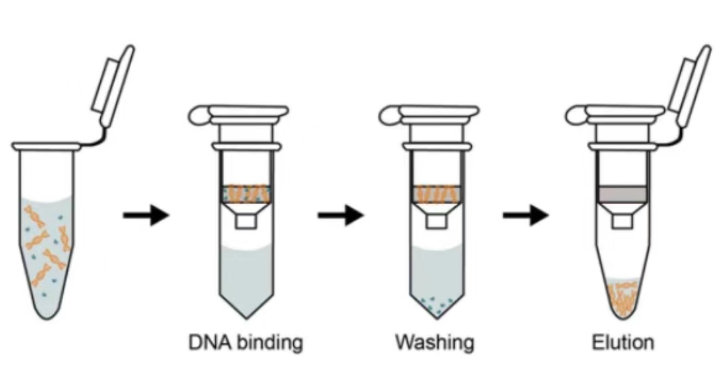
图1、DNA提取的简明流程
一、细菌基因组DNA的制备
1、实验材料
细菌培养物。
2、实验设备
移液管,高速冷冻离心机,台式离心机,水浴锅。
3、实验试剂
(1)CTAB/NaCl溶液 4.1gNaCl溶解于80mLH2O,缓慢加入10gCTAB,加水至100mL。
(2)其他试剂 氯仿:异戊醇(24:1),苯酚:氯仿:异戊醇(25:24:1),异丙醇,70% 乙醇,TE,10% SDS,蛋白酶K(20mg/mL或粉剂),5mol/L NaCl。
4、操作步骤
(1)100mL细菌过夜培养液,5000r/min离心10min,去上清。
(2)加9.5mL TE悬浮沉淀,并加0.5mL10% SDS,50μL 20mg/mL(或1mg 干粉)蛋白酶K,混匀,37℃保温1h。
(3)加1.5mL 5mol/L NaCl,混匀。
(4)加1.5mL CTAB/NaCl溶液,混匀,65℃保温20min。
(5)用等体积苯酚:氯仿:异戊醇(25:24:1)抽提,5000r/min离心 10min,将上清移至干净离心管。
(6)用等体积氯仿:异戊醇(24:1)抽提,取上清移至干净管中。
(7)加1倍体积异丙醇,颠倒混合,室温下静置10min,沉淀DNA。
(8)用玻璃棒捞出 DNA 沉淀,70%乙醇漂洗后,吸干,溶解于1mL TE,-20℃保存。如 DNA 沉淀无法捞出,可5000r/min离心,使DNA沉淀。
二、丝状真菌基因组DNA的制备
1、丝状真菌基因组的大量提取
(1)以每克经过滤抽干的菌丝体加4mL CTAB抽提液(2% CTAB;100mmol/L Tris-HCI,pH8.0;20mmol/L EDTA,pH8.0;1.4mol/L NaCl),加入2-巯基乙醇(2-ME)至终浓度为2%(体积分数)。
(2)菌丝体加入液氮冷冻,研磨至细小粉末状。把粉末加入到预热的2-ME/CTAB抽提液中,涡旋混匀,65℃保温45~60min,不时颠倒混匀。
(3)加入等体积苯酚:氯仿:异戊醇溶液,颠倒混匀,12000r/min 离心 20min。
(4)取上层水相至另一离心管中,加入0.5~0.6倍体积冰冷的异丙醇,颠倒混匀,4℃放置 20min,12000r/min 离心 10min。
(5)去上清,以70%乙醇洗涤沉淀两次,真空干燥后用适量TE缓冲液完全溶解。
(6)加入等体积冰预冷的5mol/ LiCL,混匀,12000r/min 离心 10min。
(7)转上清至另一新离心管中,加0.5~0.6倍体积冰冷的异丙醇,混匀,-20℃放置 20min,12000r/min 离心10min。
(8)70%乙醇洗涤沉淀,真空干燥。
(9)以含50μg/mL RNase的超纯水完全溶解沉淀,37℃温育1h,-20℃保存备用。
2、丝状真菌基因组的小量提取
(1)约0.1g的菌丝体置于1.5mL的离心管中,加入300μL的提取缓冲液(100mmol/LTis-HCI,pH 8.0;100mmol/L EDTA;250mmol/L NaCl;1% SDS),用带塑料钻头的手持式电钻进行研磨约30s。
(2)加入等体积氯仿:异戊醇(24:1)抽提,12000r/min 离心 15min。
(3)取上清,加入0.6倍体积异丙醇,混匀,-20℃放置20min,12000r/min离心10min。
(4)70%乙醇洗涤沉淀,真空干燥。
(5)以含50μg/mL RNase的超纯水完全溶解沉淀,37℃温育1h,-20℃保存备用。
三、酵母基因组DNA的制备
操作步骤如下:
(1)划线法在YPD平板上活化酵母菌,28℃培养,2天后长出单菌落。
(2)挑取活化的单菌落接种于5mL YPD培养基中,28℃,180r/min 振荡培养8~10h。
(3)移取1.5mL菌液至无菌EP管中,5000r/min 离心5min,弃上清。
(4)将菌体悬浮于0.5mL 1mol/L山梨醇,0.1mol/L Na2EDTA,pH 7.5的缓冲液中。
(5)加入0.02mL 10mg/mL消解酶溶液,37℃保温60~120min。
(6)10000r/min 离心 1min,弃上清,菌体重悬于0.5mL 50mmol/L Tris-HCL,20mmol/L EDTA(pH7.4)的缓冲液中。
(7)加入0.05mL10% SDS,混匀,65℃保温30~60min。
(8)加入0.2mL 5mol/L乙酸钾溶液,冰浴60min,12000r/min 离心 10min。
(9)移取上清至新的EP管中,加入 1/10体积的3mol/L乙酸钠(pH5.2)和2倍体积的无水乙醇,混匀,-20℃过夜沉淀,12000r/min离心10min,将沉淀用70%乙醇洗一次,室温干燥。
(10)将沉淀悬浮于100μL TE(pH7.4)缓冲液中,加入2μL无DNase 的10mg/mL RNase,37℃,保温 30min。
(11)提取的基因DNA用双蒸水稀释适当倍数后,在紫外分光光度计上测定OD260和 OD280,计算 DNA 纯度和浓度。OD260/OD280值介于1.8~2时,DNA 纯度较高。DNA浓度(μg/mL)=OD260值x50μg/ml x稀释倍数。DNA样品贮存于-20℃。
四、基因组DNA的检测
上述方法得到的DNA一般可以用作Southern、RFLP、PCR等分析。由于所用的材料不同,得到的 DNA产量及质量均不同。有时DNA中含有酚类和多糖类物质,会影响酶切和PCR的效果。所以获得基因组DNA后,均需检测DNA的产量和质量。
(1)DNA 溶液稀释20~30倍后,测定OD260/OD280比值,明确 DNA的含量和质量。
(2)取2~5μL在0.7%琼脂糖胶上电泳,检测DNA的分子大小。
(3)取2μgDNA,用10单位(U)Hind Ⅲ 酶切过夜,0.7%琼脂糖胶上电泳,检测能否完全酶解(做RFLP,DNA 必须完全酶解)。
如果DNA中所含杂质多,不能完全酶切,或小分子DNA多,影响后续的分析和操作,可以用下列方法处理:
(1)选用幼嫩植物组织,可减少淀粉类的含量。
(2)苯酚:氯仿抽提,去除蛋白质和多糖。
(3)琼脂糖凝胶柱过滤,去除酚类、多糖和小分子 DNA。
(4)CsCl梯度离心,去除杂质,分离大片段DNA(可用作文库构建)。
总结
本文综合介绍了细菌、丝状真菌和酵母基因组DNA的提取方法,不仅覆盖了从样本准备到DNA纯化保存的全过程,还强调了提取过程中应注意的关键点和质量控制措施。通过实施这些标准化操作流程,科研人员能够获得高纯度的基因组DNA,为后续的分子生物学研究奠定坚实基础。同时,提供的质量评估策略确保了DNA样品的适用性,无论是进行基本的遗传分析还是复杂的基因组学研究。
参考文献:Guide to experiments of molecular microbiology
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2024-05-14
#创作团队
编制人:冬冬
