简单却有效:室温蒸馏水法在四种担子菌门真菌长期保存中的卓越表现
来源:武汉市灰藻生物科技有限公司 浏览量:247 发布时间:2025-09-08 21:09:17
摘要
本研究旨在确定4种担子菌门真菌的最佳保存方法。
供试菌种包括,姬松茸(Agaricus blazei)、灵芝(Ganoderma lucidum )、灰树花(Grifola frondosa)和肺形侧耳(Pleurotus pulmonarius )。
我们采用了3种保存方法,并对其进行了为期12个月的评估,期间持续监测菌种的存活情况,同时还研究了它们的生长动力学、生物量及多糖产量。
具体实施的保存方法包括:
1. 24 ºC蒸馏水保存;
2. 添加10%甘油的锯末和米糠基质,于-20 ºC下冷冻保存;
3. 添加10%甘油的锯末和米糠基质,于-80 ºC下冷冻保存;
4. 使用海藻糖或脱脂奶作为保护剂进行生物质冷冻干燥。
经过12个月的保存期并对结果进行分析后,我们确定,24 ºC蒸馏水处理是效果最佳的保存方法。在第12个月时,其菌种复苏率最高,达到83.3%。
其次是-80 ºC的冷冻保存法,复苏率为75%,且该方法对菌株后续的生物量和多糖产量均无负面影响。
相比之下,-20 ºC冷冻保存和冷冻干燥法的效果均不理想。在-20 ºC下保存的菌株仅在第一个月能成功复苏;而采用冷冻干燥法处理的菌株,在整个12个月的评估期内均无法成功复苏。
关键词:冷冻保存,冷冻干燥,担子菌,生物量,胞外多糖,胞内多糖
介绍
近年来,利用微生物来推动商品服务行业和环境治理已成为实现技术可持续发展的一个重要方向。在这一领域中,担子菌的应用尤为突出,用途极为广泛,包括生物修复、酶制剂生产、木质纤维素残渣降解、药品研发以及功能性食品开发等。
随着这类担子菌的工业应用日益增多,如何优化利用资源、提高生物质、多糖、蛋白质、酶等工业产品的产量,就成为必须解决的问题。
因此,建立异地保存(ex-situ conservation)技术规范显得至关重要。这不仅是为了长期保持菌种的存活,更是为了完整保留其形态、生理和遗传特性。
在以往的菌种维护过程中,常常因各种因素导致产量下降或产品质量不佳,食用菌产业在过去几年中就深受其扰。目前,市场迫切要求提高现有食用菌的产量与质量,并加强针对这些菌种的专用培养基配方、培养条件及保存工艺的研究。
为了基于现有及有潜力的担子菌种持续开发创新性应用,本研究评估了4种具有工业价值的担子菌的不同保存方法。
鉴于其药用、功能性和工业用途,姬松茸、灵芝、灰树花和肺形侧耳这四种真菌已被广泛研究。这些菌种的特色在于富含β-D-葡聚糖(β(1→3), β(1→6))、蛋白聚糖、三萜类化合物(如灵芝酸)、酚类化合物等多种活性成分。这些成分赋予它们免疫刺激、降血糖、抗真菌、抗病毒、抗菌、抗炎、抗过敏、抗氧化以及降低胆固醇等多种生物活性。
为保证这些微生物的活力,通常采用传代培养或连续转接作为常规保存方法。这种方法虽能管理菌株且无需频繁购买新种以节省成本,但并不适用于保存大量菌种。同时,该方法耗时、易污染,且无法避免长期储存过程中可能发生的遗传和生理变化。
为克服这些缺点,人们开发了多种方法,例如:将琼脂块保存于无菌蒸馏水或矿物油中、石蜡封存于15°C、液氮超低温保存以及冷冻干燥法等。然而,需要指出的是,尽管液氮保存能确保稳定性,但其操作可能与传代培养一样繁琐。样品必须根据物种特性以特定的降温速率冷冻至-40°C,然后才能置于-196°C下保存,以确保对微生物无任何负面影响。此方法成本高昂,且其效果受菌丝年龄、基质、冷冻保护剂的有无与种类、解冻温度等多种因素影响,结果不稳定。
除了上述方法,还有其他如-70/-85°C深低温冷冻和冷冻干燥等技术也被应用于真菌菌株的保存。在某些案例中,这些方法已被证明能有效保持菌种的复苏能力及其特定特性,如生长速率、酶活性和高度的遗传稳定性。已有实验证实,部分担子菌物种在-85°C下冷冻10年后仍能存活,甚至有些菌株在复苏三个月后,在经过为期六个月的反复冻融循环后,仍能成功产出子实体。
由于目前尚未建立起针对某些担子菌的、完善的冷冻干燥方法,因此需要进一步实验来确定其有效性和可行性。因为实验结果的优劣很大程度上受操作流程细节的影响,例如所使用的悬浮溶液类型以及冷冻前的灌注时间等。
多种因素会影响保存过程的效果,包括:菌株种类、保存温度、培养基成分、储存时间以及冷冻/冻干保护剂(如甘油、二甲基亚砜、牛血清白蛋白、脱脂奶、山梨醇、海藻糖或肌醇等)。很少有微生物能在无保护剂的情况下在保存后存活,这些保护剂能延长存储时间,并避免细胞损伤。
基于以上背景,本研究旨在以姬松茸、灵芝、灰树花和肺形侧耳为模型,分析和寻找非常规、实用且经济的担子菌菌株保存方法,以期建立一种最佳且成本低廉的保存方案,便于后续使用。本项目评估了保存12个月后各菌株的生长动力学、生物量、胞外多糖(EPS)和胞内多糖(IPS)的产量。所测试的保存方法包括:24°C蒸馏水保存、添加10%甘油的锯末米糠基质在-20°C下保存、同样基质在-80°C下保存、以及使用海藻糖或脱脂奶作为保护剂进行生物质冷冻干燥。
材料和方法
菌株培养
本研究使用的四种担子菌——姬松茸(A. blazei)、灵芝(G. lucidum)、灰树花(G. frondosa)和肺形侧耳(P. pulmonarius)的菌种,均由安蒂奥基亚大学植物生物技术研究小组提供。所有菌株均在该小组自行设计的标准真菌培养基 MGL1 中进行维护。该培养基的成分为(克/升):大麦粉-30,酵母提取物-3,蔗糖-5.3,琼脂-8,pH值调整为5.5 ± 0.1。
保存方法的评估
本研究采用的保存方法包括:室温(24°C)蒸馏水法、冷冻保存法(-20°C 和 -80°C)以及冷冻干燥法。所有处理的评估周期均为12个月。
• 蒸馏水处理:
从生长旺盛的菌落边缘切取直径为1厘米的菌丝琼脂块,转移至装有1毫升无菌蒸馏水的2毫升小瓶中,置于24 ± 1°C条件下保存。每个处理设置三个重复,并分别在保存1、6和12个月后进行分析。复苏菌株时,直接将菌丝琼脂块接种到MGL1琼脂培养基上,在24 ± 1°C黑暗条件下培养15天。
• 冷冻保存过程(-20°C 和 -80°C):
同样从活跃生长的菌落边缘切取1厘米的菌丝琼脂块,转移至2毫升小瓶中。冷冻保护剂为1毫升10%的甘油,并辅以0.05克锯末和0.05克米糠作为基质。小瓶于-20°C下储存。每个处理设三个重复,于保存1、6和12个月后分析。采用相同的方法处理储存于-80°C的小瓶。复苏时,将小瓶在24 ± 1°C下解冻,然后接种到MGL1琼脂上,在黑暗条件下培养15天。
• 冷冻干燥过程:
从活跃生长的菌落边缘切取1厘米的菌丝琼脂块,接种于65毫升MGL1液体培养基中进行深层发酵培养。该液体培养基成分为(克/升):大麦粉-50,NaNO₃-0.08,MgSO₄·7H₂O-0.02,KCl-0.01,KH₂PO₄-0.03;pH 5.5 ± 0.1。培养12天后,取10毫升含有生物质的培养液,根据样本不同,分别与5毫升10%(w/v)的脱脂奶或10%(w/v)的海藻糖溶液混合,置于锥形管中,准备进行冷冻干燥。每个处理设三个重复,于保存1、6和12个月后分析。复苏时,将5毫克冷冻干燥后的生物质重新悬浮于5毫升蒸馏水中,在24 ± 1°C下静置1小时。然后,从各样品中提取片段,接种于MGL1琼脂培养基上,在24 ± 1°C黑暗条件下培养15天。
菌株存活能力评估
• 培养皿中生长速率与生物量测定:
菌丝生长速度的测量参考了Donini等人描述并经作者修改的方法。使用毫米尺,每24小时一次,在四个方向上测量培养皿中菌落的生长直径,直至菌丝长满整个培养基。最后一次测量后,将每个培养皿中的琼脂和菌丝体置于沸水中,以分离真菌生物质与琼脂。随后,将生物质在70°C的烘箱中干燥至恒重。结果以克/培养皿为单位记录。
• 深层培养中生物量、胞外多糖(EPS)和胞内多糖(IPS)的测定:
o 生物量生产:
将复苏的菌株在MGL1琼脂上再次培养(继代培养)。取1厘米的菌丝琼脂块,接种到装有63毫升MGL1液体培养基的250毫升锥形瓶中。这些培养物在100 rpm、24 ± 1°C、12小时光照/12小时黑暗的条件下培养12天。
o 从每个锥形瓶中获得的生物质用35目筛网过滤,用大量蒸馏水冲洗,最后在70°C的烘箱中干燥至恒重。
o 多糖(EPS和IPS)的提取:
IPS提取:从1克干生物质开始,用沸水提取多糖20分钟,立即用125毫米直径的滤纸过滤溶液。向滤液中加入4倍体积的96%乙醇,将此混合物于4°C静置至少1小时。最后,在-4°C、4000 rpm下离心20分钟,弃去上清液,将沉淀重新溶解于5毫升蒸馏水中。
EPS提取:将过滤后的培养液在2500 rpm、25°C下离心以去除悬浮固体。取10毫升上清液,加入4倍体积的96%乙醇。此后,遵循与IPS相同的 protocol 以获得多糖提取物。
o 多糖定量:
采用Dubois等人报道并经Masuko等人改良的酚-硫酸比色法对IPS和EPS进行定量。样品测量在微孔板中进行。
实验设计
本研究采用的实验设计为多因素方差分析(multifactor ANOVA),完全随机化,每个处理设3个重复。评估了两个因素:保存方法和菌种,目的在于确定培养12天后,生物量和多糖的平均产量是否存在差异。该设计使用StatGraphics Centurion XV软件进行评估。
结果
所有参与评估的菌株均在保存1、6和12个月后尝试进行复苏。其中,-20°C冷冻法仅在第一个月成功复苏了4种真菌中的3种,且相关数据不具备代表性(数据未显示)。而对于冷冻干燥处理的样品,则观察到了菌株完全失活的现象。因此,只有蒸馏水法和 -80°C冷冻法这两组数据适合进行后续分析。
不同的保存方法以及保存时间都对菌株的生长动力学产生了影响。从(图1)可以观察到,与蒸馏水法相比,-80°C冷冻法保存的菌株其菌丝生长存在一定的延迟。
然而,在本研究中,这并未构成负面影响,因为两种方法的菌丝长满整个培养皿所需的天数相近,甚至在部分案例中完全相同。
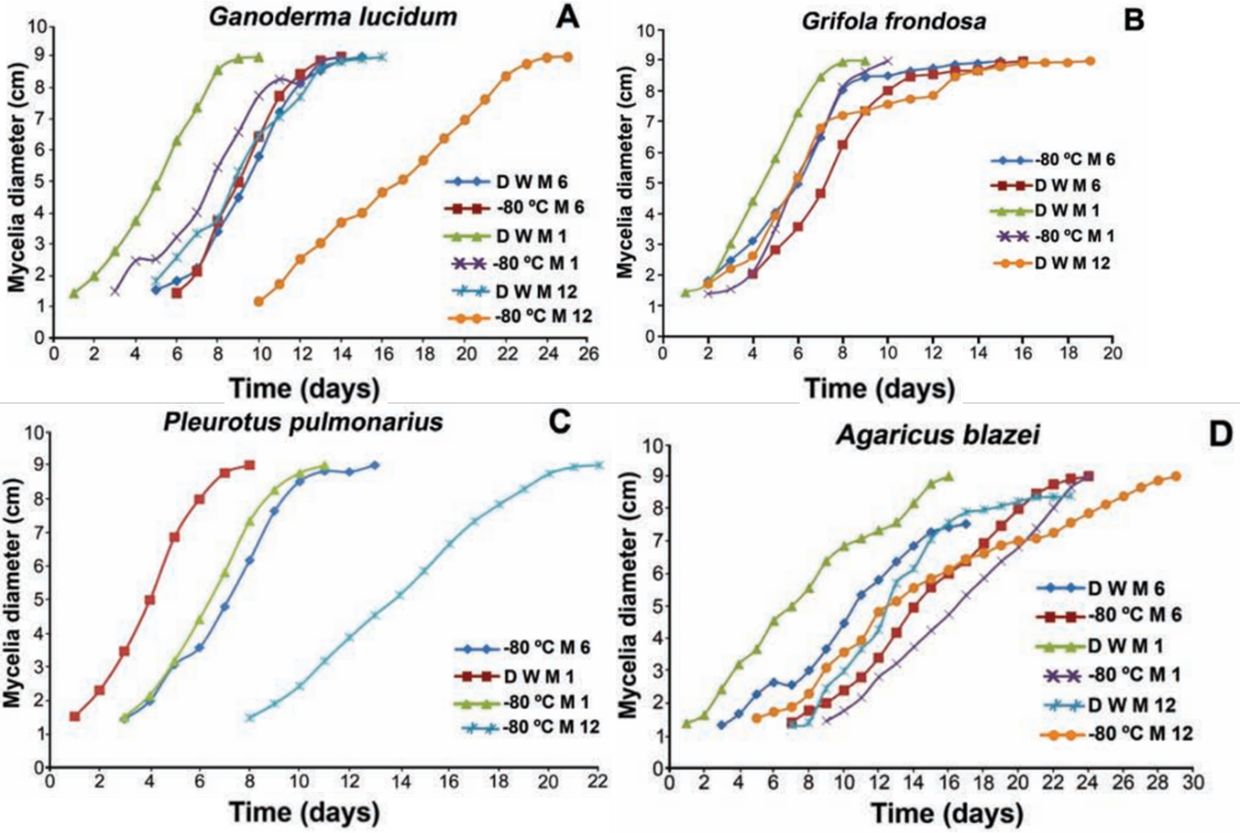
图 1. 四种真菌在培养皿中的生长动力学图:A. 灵芝;B. 灰树花;C. 肺形侧耳;D. 姬松茸(D W = 蒸馏水法; M 1 = 第1个月; M 6 = 第6个月; M 12 = 第12个月)
这一结果可以通过生物量和多糖产量的数值得到进一步印证:在某些情况下,-80°C冷冻法的产量甚至更高;仅有少数案例产量较低,但差异并不显著(图2)。为验证哪种方法是最佳方案,我们采用保存至第12个月时获得的数据进行了多因素方差分析(显著性水平设定为p值 ≤ 0.05)。分析结果表明,对于保存方法这个因素,所有响应变量(包括培养皿中的生物量、胞内多糖IPS、胞外多糖EPS以及深层培养生物量)均未显示出显著的统计学差异,其p值分别为0.4961、0.7502、0.3128和0.3631。
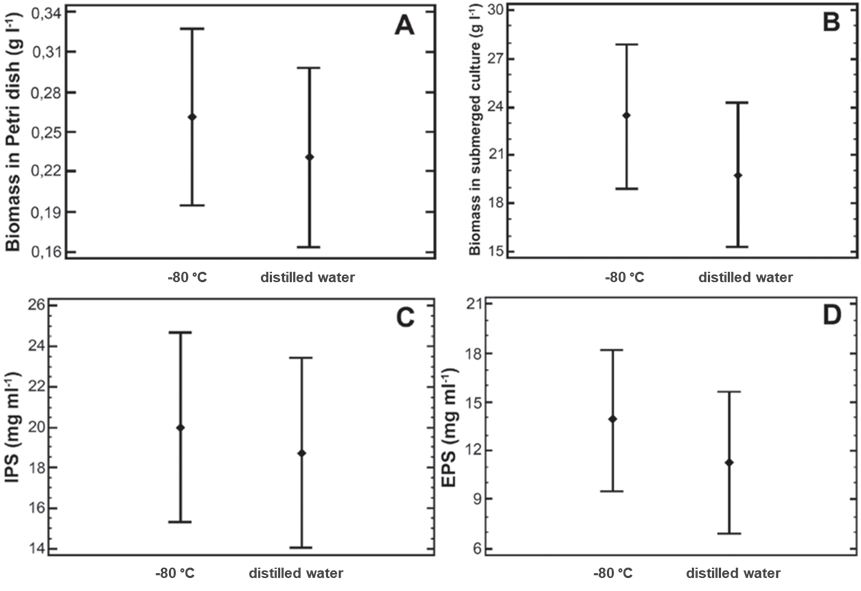
图 2. 两种保存方法(-80°C冷冻法 vs. 蒸馏水法)的均值图(平均值及95.0%费雪LSD区间)A. 培养皿中的生物量; B. 深层培养生物量; C. 胞内多糖(IPS)浓度; D. 胞外多糖(EPS)浓度
然而,对于菌种这个因素,则存在显著的统计学差异(深层培养生物量除外)。培养皿生物量、IPS和EPS的p值分别为0.0006、0.0377和0.0001。这一点在观察姬松茸(A. blazei) 的表现时尤为明显,其在四个变量中的三个平均值都明显高于其他菌种(图3)。肺形侧耳(P. pulmonarius)在某些情况下也表现出类似趋势。
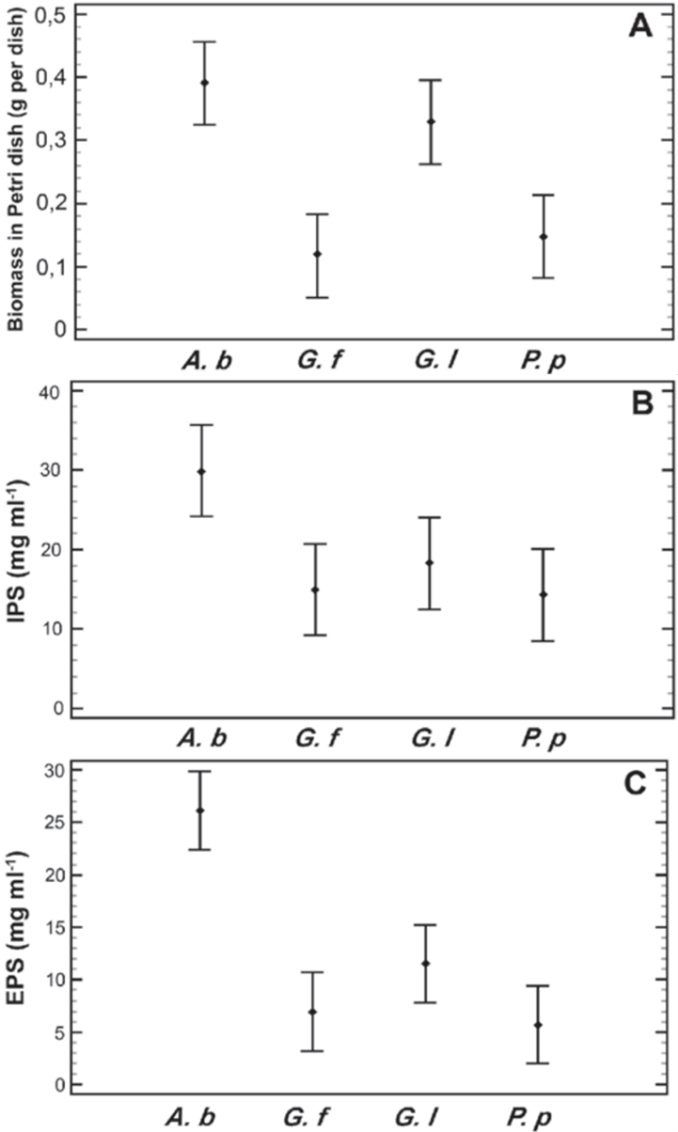
图 3. 四种真菌的均值图(平均值及95.0%费雪LSD区间)A. 培养皿中的生物量; B. 胞内多糖(IPS)浓度; C. 胞外多糖(EPS)浓度(A. b = 姬松茸; G. f = 灰树花; G. l = 灵芝; P. p = 肺形侧耳)
讨论
首先需要指出,真菌细胞抵抗不同保存方法(如冷冻保存和冷冻干燥)的能力,可能会受到菌丝年龄、生理状态以及细胞质内容物的性质等因素的影响。
在结果分析中观察到,-80°C 下的保存效果明显优于 -20°C。一个合理的解释是,在 -80°C 下细胞能得到更好的保存,因为对于某些真菌而言,较高的冷冻速率可能不会导致冰晶的形成。
在Morris等人的研究中,香菇、泪杉菌、玫瑰掷孢酵母和草菇在 -100°C/分钟的冷冻速率下未形成冰晶;而对于泪杉菌,采用先以0.5°C/分钟降至-40°C再快速冷却至-196°C的方案,其复苏率远高于以1°C/分钟直接降至-196°C的方案。冷冻和解冻过程中形成的冰晶的生长,是导致细胞损伤的关键因素。这也解释了为何-20°C保存效果不佳,因为该方法的冷冻速率较慢,可能形成了更多冰晶。
总体而言,-80°C冷冻法是一个良好的处理方法,成功实现了菌株的复苏。仅在最后一个月,有一个灰树花的重复单元未能复苏。对此,一个可行的推测是:在未能复苏的样品中,菌丝与基质(锯末米糠)的结合不够牢固。已有许多报道使用不同的基质(如藻酸盐微球、硅胶、矿物珍珠岩、被菌丝侵染的高粱粒等)的固定化技术用于冷冻保存。Mata和Pérez的报告数据甚至显示,在不使用冷冻保护剂或水的情况下直接冷冻菌种,菌丝也能从种脐或种子表面的裂缝中长出,效果更佳。这些固定化技术可以保护菌丝免受机械损伤(如冰晶形成),同时基质在冷冻前后都能作为底物。
在本研究中,我们观察到,平板上真菌菌丝的生长不仅来源于琼脂块,也来源于接种到培养基中的锯末颗粒。这证实了仅用琼脂作为基质可能不适合菌丝在保存过程中的附着(本研究即是这种情况),因为可以观察到冷冻后琼脂材料解体,这使得回收菌丝进行再次接种变得非常困难。
根据统计分析可以推断,蒸馏水保存法是姬松茸、灵芝和灰树花的最佳方法。这意味着该方法可靠、可信、简单且非常经济。这一结论得到了Burdsall等人研究的支持,他们评估了151种担子菌,其中94%的分离菌株在蒸馏水中保存七年后仍具活力。在我们的案例中,蒸馏水法在第12个月实现了83.3% 的复苏率,高于-80°C冷冻法的75%。然而,必须强调的是,对于肺形侧耳而言,-80°C冷冻法却是最合适的方法,并且在无法进行液氮冷冻保存时(因其成本更高、操作更繁琐且需设定冷冻速率),这是一个很好的替代方案。该菌株在蒸馏水中无法生长的一个可能原因是其对水分的要求可能更高,水分蒸发导致水量不足,无法支撑整个保存期。
不同保存方法对多糖生产的影响是一项新的发现,因为目前大多数研究仅关注复苏率、生长速率和酶活性等响应变量。本研究发现,除蒸馏水保存的肺形侧耳外,所有菌种和处理的多糖产量均未受到显著的负面影响。相反,我们观察到产量有所上升:灵芝、灰树花和姬松茸的IPS值分别为18.29, 14.94, 29.94 mg/ml,EPS值分别为11.50, 6.977, 26.11 mg/ml(图3)。相比之下,其他作者报道的数值分别为:灵芝、灰树花和姬松茸的IPS为4.74, 1.3, 1.40 mg/ml,EPS为10.5, 7.2, 5.08 mg/ml。目前未找到关于肺形侧耳IPS和EPS产量的报道以供比较。大部分较高的数值出现在IPS产量上,这可能是菌丝应对低温、营养缺乏或水分活性不足等不利条件的一种应激反应,并在复苏后的固体和液体培养基中体现出来。因此可以推断,这可能是菌丝体的一种保护机制,通过积累IPS和分泌高于正常生长水平产量的EPS来保护自身免受损伤。尽管关于保存方法对真菌多糖产量影响的报道很少,但这些结果可与酵母等其他真菌的行为相比较,已有报道表明在胁迫条件下酵母会积累多糖,并且这类多糖本身也具有冷冻保护作用。
另一种可能的解释与抗冻物质(如蛋白质和糖蛋白)的产生有关。在一些担子菌(如Coprinus psychromorbidus, Flammulina populicola, 香菇, Typhula ishikariensis)中已报道存在抗冻蛋白。对于本研究中的真菌,特别是多糖产量最高的姬松茸,分析其是否含有具此类功能的糖蛋白会非常有趣,这可被视为一种获得多糖高产菌株的途径。
关于冷冻干燥法,在本次应用的条件下证明不适用于所有菌株,因为它们均失活了。这在第一个月的复苏尝试中就得到证实:经过一个月培养后,湿润的菌丝仍无法增殖,从而证实了水分活度在营养菌丝稳定性中的重要性。本实验的流程是从深层培养获得的生物质开始进行冷冻干燥,在此状态下,所评估的真菌不形成孢子;而对于大多数担子菌而言,只有孢子结构才能承受这种极端的脱水条件。不过,也有少数例外,如一些菌根真菌已成功抵抗并存活于这种严酷条件。
尽管冷冻干燥可作为保存丝状真菌的众多方法之一,但必须注意,为了获得最佳存活率且无附带损伤,需要严格的protocol:不仅在于冷冻干燥时选择和使用正确的保护剂,还在于培养期间选择合适的细胞内积累剂以减少冰晶形成;此外,确定冷冻前的降温速率并控制干燥速率也至关重要。因此,需要许多特定条件并进行大量的方法标准化工作,才能使其成为一种有效且无副作用的实用技术。
根据所有结果,我们建议将蒸馏水法作为首选保存方法,因为它复苏率最高(83.3%),且实用性强,能降低化学品和设备相关的成本。然而,对于肺形侧耳等特定情况,则建议采用 -80°C冷冻保存法。
核心要点总结
| 序号 | 核心要点 | 具体说明 |
|---|---|---|
| 1 | 研究目的 | 寻找对姬松茸、灵芝、灰树花、肺形侧耳这四种高价值真菌长期(12个月)、实用且经济的最佳菌种保存方法。 |
| 2 | 测试方法 | 系统比较了四种方法:室温蒸馏水法(24°C)、-20°C冷冻法、-80°C冷冻法(后两者使用锯末米糠基质)、冷冻干燥法。 |
| 3 | 最佳方法 | 室温蒸馏水法。效果最好,12个月后复苏率最高(83.3%),且操作最简单、成本最低。 |
| 4 | 次优方法 | -80°C冷冻法。复苏率良好(75%),对菌株后续生产能力无影响,是保存肺形侧耳的唯一有效方法。 |
| 5 | 无效方法 | -20°C冷冻法效果很差;冷冻干燥法完全失败,所有菌株均无法复苏。 |
| 6 | 意外发现 | 保存后的菌株其多糖产量(IPS和EPS)显著高于文献值,提示保存过程作为一种“胁迫”可能刺激活性物质生成。 |
| 7 | 最终结论 | “方法不在贵,而在乎对”。对于这些真菌,简单廉价的室温蒸馏水法是首选,且菌种本身特性是决定产量的主要因素。 |
对菌种保存的指导意义
| 序号 | 指导意义 | 具体说明 |
|---|---|---|
| 1 | 挑战传统认知 | 证明简单方法(如蒸馏水法)可能优于复杂昂贵的技术(如超低温冷冻、冷冻干燥),颠覆了“技术越先进效果越好”的固有思维。 |
| 2 | 提供明确决策路径 | 为菌种保藏机构和个人提供了清晰的优先选择方案: 1. 首选尝试:未知菌种可优先尝试低成本、低技术门槛的蒸馏水法。 2. 技术备选:若无效,再采用 -80°C冷冻法。 |
| 3 | 避免常见误区 | 明确指出-20°C(普通冰箱冷冻室温度)不足以有效保藏菌种,以及未经优化的冷冻干燥法极易失败,避免了资源和时间的浪费。 |
| 4 | 确立更全面的评估标准 | 评估保存方法不应只看“能否存活”,更应关注存活后的“生产能力”(如生物量、多糖产量)和遗传稳定性,这对工业应用至关重要。 |
| 5 | 启发新的研究方向 | 发现的“胁迫增产”现象为通过物理/化学胁迫诱导菌株高产目标代谢物(如多糖)提供了新的研究思路和方向。 |
参考文献
Palacio A ,Gutiérrez, Yessica, Rojas D ,et al.Viability of Basidiomycete fungal strains under different conservation methods: cryopreservation vs. freeze-drying processes[J].Actu Biol, 2017, 36(100):13-21.DOI: https://doi.org/10.17533/udea.acbi.329101
【相关产品】
HZB598459:Pleurotus pulmonarius
敬请关注灰藻生物,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-09-06
编制人:小灰
审稿人:小藻
