病毒吸附、侵入、合成和装配等增值过程,以及感染类型和影响因素等介绍
来源:武汉市灰藻生物科技有限公司 浏览量:1374 发布时间:2025-06-28 15:54:14
引言
病毒缺乏细胞的细胞器、代谢必需的酶系统和能量,不能独立地,以分裂方式进行繁殖。而是在宿主活细胞内,控制其生物合成机构,利用宿主细胞的能量和原料,合成病毒核酸与蛋白质等成分,再装配成新的病毒粒子,以复制方式进行。病毒繁殖,是病毒基因组在宿主细胞内复制与表达的结果,这种繁殖方式与其他微生物不同,称为增殖。与细胞微生物不同,病毒粒子不存在个体长大的过程,同种病毒粒子间,没有年龄和大小之分。
一、病毒的增殖过程
各种病毒的增殖过程基本相似,一般可分为:吸附、侵入、合成、装配、释放5个阶段。整个增殖过程很快,如大肠杆菌T噬菌体,在温度等条件合适时,增殖仅需15~20min。
1.吸附
吸附是指病毒通过其表面的吸附蛋白,与宿主细胞表面的吸附受体,发生特异结合的过程。病毒粒子由于随机碰撞或布朗运动、静电引力与敏感细胞表面接触,通过病毒表面吸附蛋白,与细胞受体间的结构互补性,及相互间的电荷、氢键、疏水性相互作用、范德瓦耳斯力等,吸附于宿主细胞表面的特异受体上。这些受体并非为病毒感染特地表达的,它们多数是细胞表面的特定蛋白质、多糖、糖蛋白和脂蛋白。病毒一个吸附蛋白分子与宿主一个受体蛋白分子结合并不紧密,病毒粒子多个位点与多个受体结合很牢固。菌体尾丝尖端与宿主细胞表面的特异受体接触,就可触发颈须把卷紧的尾丝散开,随即就吸附在受体上,将刺突、基板固定于宿主细胞表面(图1)。
噬菌体和包膜病毒表面的蛋白质结构(吸附点),与宿主细胞表面特异性受体有“互补”关系,两者有一方发生突变或被破坏,则吸附和感染均不能发生。病毒的宿主受体有种系和组织特异性,这些特性决定病毒的宿主谱。不同病毒粒子有不同吸附位点,如大肠杆菌T3、T4、T7,噬菌体吸附在脂多糖受体上,T2和T6,噬菌体吸附在脂蛋白受体上。有些复杂的病毒有几种吸附位点,分别与不同受体作用。另外,不同宿主细胞也有不同病毒吸附受体。有的宿主细胞有不同病毒的受体,可被多种病毒感染。最近发现有些病毒如人类免疫缺陷病毒等的感染需要辅助受体参与。无特殊吸附结构的动物病毒只能通过吞作用或胞吞作用被动进入宿主细胞。植物病毒除莴苣坏死黄化病毒等有刺突外,其余均无专门的吸附结构。而且,在植物细胞表面尚未发现病毒特异的受体。
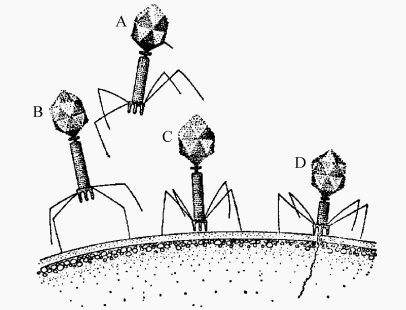
图1 T4噬菌体吸附及侵入的示意图
A.尚未吸附;B.尾丝吸附;C.刺突固定;D.核酸注入
吸附受许多内外因素影响。影响细胞受体和病毒吸附蛋白活性的代谢抑制剂、酶类、脂溶剂、抗体及温度、离子浓度、pH等环境因素均影响病毒吸附。pH中性时有利于吸附,pH小于5或大于10时均不易吸附。在生长最适温度范围内最有利于吸附。一价、二价阳离子如Na+、Ca2+、Ba2+、Mg2+促进吸附,Al3+、Fe3+、Cr3+等三价阳离子可使病毒失活。
2.侵入
指病毒或其一部分进入宿主细胞的过程,需要能量。侵入方式取决于宿主细胞性质尤其是表面结构。大部分菌体由尾部的溶菌酶溶解接触处细胞壁中的肽聚糖,使细胞壁产生一个小孔,然后尾鞘收缩,将尾管压入细胞,通过尾管将其头部核酸注入细菌中,蛋白质外壳留在菌体外(图1)。T4菌体在条件适宜时,从吸附到侵入只需15s。
动物病毒侵入宿主细胞有三种方式。
①膜融合:包膜病毒的刺突与宿主细胞受体结合,促进病毒包膜与宿主细胞膜融合,核衣壳释放到细胞质内,如流感病毒。
②胞吞:吸附的病毒被细胞膜包围,在细胞质内形成吞噬泡将整个病毒粒子包入宿主细胞,如痘类病毒,是动物病毒侵入宿主细胞的主要方式。
③直接穿过细胞膜:主要是无包膜病毒,如呼肠孤病毒。
植物有角质化或蜡质化的表皮和坚硬的细胞壁,植物病毒的侵入通常由表面伤口直接侵入或通过昆虫口器侵染,并通过胞间连丝、导管和筛管在细胞间乃至整个植株中扩散。
脱壳是指病毒颗粒脱去包裹其核酸的衣壳及包膜,释放出核酸的过程。噬菌体的侵入与脱壳同时进行,仅有病毒核酸和结合蛋白进入细胞。动植物病毒以整个粒子或整个核衣壳侵入,必须脱去包膜和衣壳才能释放出病毒核酸,这是病毒核酸复制和转录的必要前提,方式因种而异。通过胞吞方式侵入的病毒,病毒包膜和宿主细胞膜融合,核衣壳在吞噬泡中溶酶体酶的作用下将衣壳降解,释放出核酸。结构复杂的病毒如痘类病毒脱壳分两步,先在宿主细胞溶酶体酶作用下除去外壳,将病毒部分蛋白质及核酸释放到细胞质内,转录mRNA,翻译出病毒脱壳酶,再在脱壳酶作用下彻底脱壳,将病毒DNA从核心中释放。
3.合成
合成指病毒在宿主细胞内复制病毒核酸和合成病毒蛋白质的过程。此时宿主细胞内没有完整的病毒粒子,失去感染性,进入隐蔽期,开始病毒的生物合成。同时宿主细胞代谢不再由本身支配,而受病毒核酸携带的遗传信息控制,宿主细胞DNA、mRNA和蛋白质的合成先后停止。病毒利用宿主细胞的合成机构和物质复制病毒核酸并合成病毒蛋白质。
T4噬菌体的基因可分三类:
一类编码早期蛋白,一类编码中期蛋白,还有一类编码晚期蛋白。
以病毒基因组的复制为时间界限,在此之前合成的蛋白质称早期蛋白,同期合成的称中期蛋白,之后合成的称晚期蛋白。早期蛋白和中期蛋白都是参与DNA复制和转录的酶。晚期蛋白是头部和尾部蛋白及参与病毒释放的酶类。病毒的合成有严格的时序性,在宿主细胞内病毒基因组从核衣壳中释放后,首先利用宿主细胞的RNA聚合酶转录早期基因,合成它们的早期mRNA,与宿主多聚核糖体结合翻译成早期蛋白,修饰宿主细胞的RNA聚合酶。利用早期合成的和修饰宿主细胞的RNA聚合酶转录病毒中期基因,形成中期mRNA和中期蛋白。
其中有的是抑制蛋白,可抑制宿主大分子物质的合成,使细胞转向有利于合成病毒,如分解宿主DNA的DNA酶,停止宿主基因表达并为病毒DNA合成提供前体;一部分是病毒所必需的复制酶,如复制病毒DNA的DNA聚合酶,用以复制子代基因组。中期基因还编码第二次修饰宿主细胞RNA聚合酶的蛋白质以转录病毒晚期基因。基因组复制完成即开始晚期转录,在中期基因产物作用下,晚期基因转录产生晚期mRNA,经晚期转译大量产生病毒衣壳蛋白等结构蛋白和在病毒装配中所需的非结构蛋白,如各种装配蛋白、溶菌酶等酶类(图2)。病毒合成数量也受严格的调控,早期蛋白大部分是酶类,表达量较少;晚期蛋白主要是病毒结构蛋白,合成量较大。
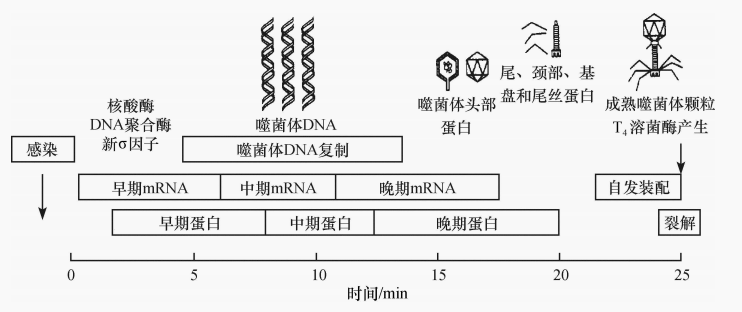
图2 T4噬菌体转录的三个阶段
根据病毒核酸的类型及如何转录 mRNA,病毒的复制与转录方式分6种类型
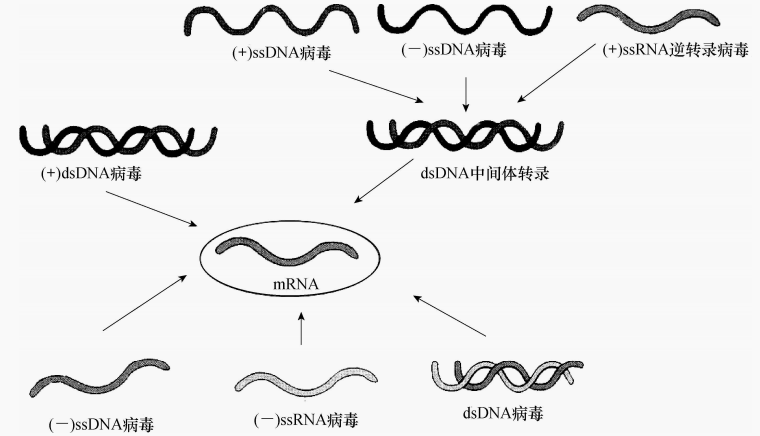
图3 不同核酸型病毒在宿主内mRNA的合成方式
(1)双链DNA病毒,经半保留复制子病毒(±)DNA,以其(-)DNA为模板合成mRNA.
(2)单链(+)DNA病毒,先由(+)DNA合成(-)DNA,组成(±)DNA,再以新合成的(-)DNA为模板合成mRNA和子代(+)DNA。
(3)双链RNA病毒,先以(-)RNA为模板合成(+)RNA即mRNA,它既可翻译出蛋白质,又可作模板合成(-)RNA。新合成的(-)RNA和(+)RNA组成子代病毒的双链RNA分子。只有(-)RNA才能作为起始模板,而亲代RNA不能用于子代基因组中。
(4)侵染性单链RNA病毒,其基因组(+)RNA既可作mRNA指导病毒蛋自合成,又可作模板复制(-)RNA,再用复制型(-)RNA为模板合成子代(+)RNA,或作mRNA合成病毒蛋白。
(5)非侵染性单链RNA病毒,这类病毒的单链(-)RNA没有侵染性,也不能起信使作用。(-)RNA用病毒粒子携带的转录酶转录出(+)RNA,再翻译出几种蛋白质,其中包括一种RNA复制酶,在此酶的作用下合成与负链等长的(+)RNA,再以此(+)RNA作模板合成子代病 毒(-)RNA。
(6)逆转录病毒,它也是(+)RNA病毒,在病毒粒子携带的逆转录酶作用下能以病毒(+)RNA作模板合成(-)DNA,再以(-)DNA作模板合成(+)DNA组成双链DNA。由此方式合成的(±)DNA不但可以作模板合成mRNA,而且能与宿主细胞的DNA整合变成宿主DNA的一部分有人认为,这就是肿瘤病毒能诱发肿瘤的原因。大部分DNA病毒在宿主细胞核内合成DNA,在细胞质内合成蛋白质。绝大部分RNA病毒其RNA和蛋白质都在细胞质中合成。有少数例外,如天花病毒的DNA在细胞质内合成,烟草花叶病毒RNA在细胞核内复制。
4.装配
装配是将分别合成的病毒核酸和蛋白质组装成完整病毒粒子的过程。其方式与病毒在宿主细胞中复制部位及其有无包膜相关。DNA病毒除疗类病毒外均在细胞核内装配RNA病毒与痘类病毒在细胞质内装配。衣壳蛋白到一定浓度时将聚合成衣壳并包裹缩合的核酸形成核衣壳。包膜病毒在细胞内组装成核衣壳,出芽释放时包上宿主细胞核膜或质膜成为成熟病毒。
烟草花叶病毒的衣壳不是由其蛋白亚基一个一个地装配而成,而是先聚集成许多双层平盘(每层17个亚基,共34个亚基)、沉降系数为20S的圆盘。以双层平盘作装配单位,同时又是组装中必需的启动者。病毒RNA有一个特殊的“起始区”,当该区与圆盘中央孔洞的多肽链的残基特异结合就形成起始复合物,使扁平的结构变化,衣壳粒呈螺旋状排列,并将RNA夹在里面,只要保持适当的pH和温度,圆盘结构有序地加到RNA链上,就能自动装配成完整的螺旋对称的病毒粒子(图4)
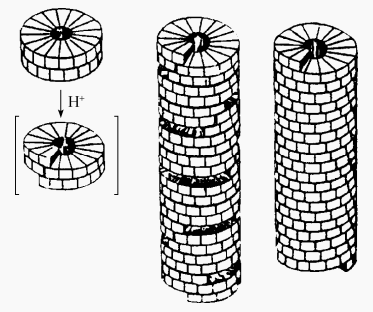
图4烟草花叶病毒蛋白质亚基的装配过程示意图
T4噬菌体的装配复杂有序,可大致分4步:
①DNA分子缩合,头部衣壳包裹DNA成头部
②由基板、尾管和尾鞘装配成尾部
③头部与尾部结合
④单独装配的尾丝与病毒颗粒尾部相接成完整噬菌体。
各装配步骤通过一系列有序装配反应进行,其中每种结构蛋白装配时都发生构型改变,为后一种蛋白质结合提供识别的位点。头部装配还需要脚手架蛋白的参与,它们在结构完成后被除去。整个装配过程约有30种不同蛋白质和47个基因参与,要在非结构蛋白指导下进行。
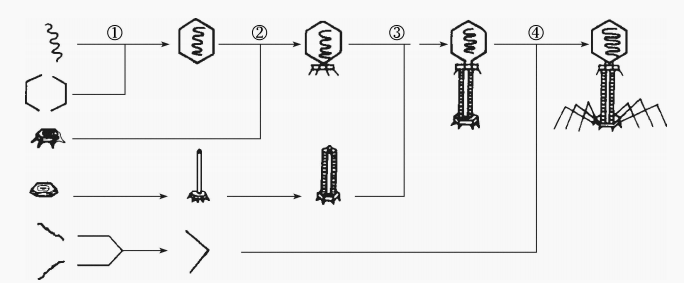
图5 T偶数噬菌体装配示意图
5.释放
释放是病毒粒子从感染细胞内转移到外界的过程。主要有以下两种方式。
(1)破胞释放细胞内无包膜病毒如T噬菌体装配完成,借助降解宿主细胞壁或细胞膜的溶菌酶、脂肪酶和神经氨酸酶等裂解宿主细胞,子代病毒一起释放到胞外,宿主细胞死亡。不同病毒有不同的释放量,为100~10000个。
(2)芽生释放有包膜病毒在细胞内合成衣壳蛋白时还合成包膜蛋白,经添加糖残基修饰成糖蛋白,转移到核膜、细胞膜上取代宿主细胞的膜蛋白。宿主核膜或细胞膜上有该病毒特异糖蛋白的部位便是出芽位置。细胞质内装配的病毒出芽时包上一层质膜成分(图6)。核内装配的病毒出芽时包上一层核膜成分。有的先包上一层核膜成分后又包上一层质膜成分,其包膜由两层膜构成,两层包膜上均有病毒编码的特异蛋白、血凝素、神经氨酸酶等,宿主细胞不死亡。有的动物病毒沿核周与内质网相通部位逐步释放。巨细胞病毒等通过细胞间连丝或细胞融合从感染细胞直接进入另一正常细胞,很少释放于细胞外。这一过程需要病毒编码的运动蛋白的参与。不管以何种方式释放的病毒粒子均可再行感染。
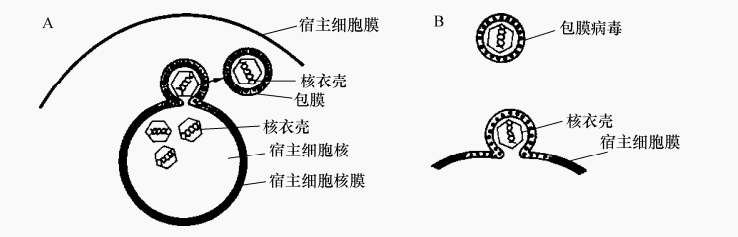
图6 包膜病毒的装配示意图
A.从宿主细胞核膜穿出时获得包膜;B.从宿主细胞膜穿出时获得包膜
二、一步生长曲线
能在宿主细胞内增殖、产生大量子噬菌体,并使细菌裂解的菌体称烈性噬菌体。定量描述烈性噬菌体增殖规律的实验曲线是一步生长曲线。
实验方法是:先把高浓度的对数期敏感细菌悬浮液与噬菌体的稀释液混合(细菌和菌体混合比例为10∶1),使噬菌体分别吸附在不同细菌上。几分钟后用抗噬菌体的抗血清中和游离菌体,再用保温培养液高倍稀释以免发生第次吸附,同时可中和抗血清的作用,使每个菌体只受一个菌体侵染。在适宜宿主细胞生长的温度下培养,定时取样接种在有敏感菌的菌苔平板上,计数菌斑数目。以噬菌斑数目为纵坐标,培养时间为横坐标作图,得到一步生长曲线。一步生长曲线(图7)可分三个时期。
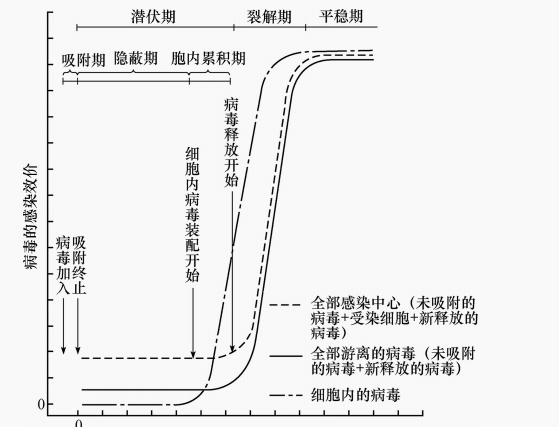
图7 T4噬菌体的一步生长曲线
(1)潜伏期是从噬菌体侵入宿主细胞到宿主细胞开始释放子代噬菌体所需时间。潜伏期噬菌斑数目不增加。不同病毒潜伏期长短不一,噬菌体一般需几分钟,动物病毒和植物病毒可以几小时甚至数天。潜伏期又分两个阶段:前一阶段在宿主细胞内检测不到完整的菌体,正在进行噬菌体核酸和蛋白质的合成,尚未装配,即自病毒进入细胞到出现新病毒的时间称隐蔽期:后一阶段噬菌体装配,宿主细胞内菌体数量急剧增加称胞内累积期。
(2)裂解期潜伏期后几分钟取的样品噬菌斑数目突然急速增加,表示已装配成成熟菌体并裂解细胞释放,直至最后一个被感染宿主细胞裂解这段时间为成熟期或裂解期。
(3)平稳期 成熟期末,感染的宿主细胞全部被裂解,噬菌斑数目在最高处达到稳定,此期为平稳期。用潜伏期的噬菌斑数(噬菌斑数是感染噬菌体的细菌数)除平稳期的噬菌斑数(噬菌斑数是噬菌体的释放数)便得到裂解量,即每个被感染细菌释放的新噬菌体颗粒的平均数。不同噬菌体有不同裂解量,如T4为100,фX174约1000,f2高达10000左右。
一步生长曲线适用于动物病毒和植物病毒研究。
三、温和噬菌体与溶源性细菌
有些噬菌体感染细菌后并不增殖也不裂解细菌,称温和噬菌体。温和噬菌体侵染敏感细菌后与细菌共存的特性称溶源性。大多数将其DNA整合到宿主基因组中,少数以质粒形式存在。可随宿主基因组同步复制,并随宿主细胞分裂进入子细胞。因不合成病毒壳体蛋白故不裂解宿主细胞。噬菌体具整合能力,能将其DNA整合到宿主菌DNA中,处于整合状态的噬菌体DNA称前(原)噬菌体。整合时需要噬菌体整合基因编码产生的整合酶,该酶能识别噬菌体与细菌之间具同源性的附着点,并催化整合过程。温和菌体有很多种,如大肠杆菌入、Mu-1、P1和P2噬菌体,鼠伤寒沙门菌P22等噬菌体。λ噬菌体头为直径55nm的二十面体,尾可弯曲、中空、非收缩,核心为线状dsDNA,两端各有一段黏性末端。感染宿主时线状dSDNA在宿主DNA连接酶的作用下环化。接着进入裂解性或溶源性周期。温和菌体一般用括号写在宿主细菌株号后面。例如,E.coli K12(λ),表示入菌体是一种温和噬菌体,寄生在大肠杆菌K12菌株细胞中。整合上噬菌体DNA的细菌称溶源性细菌。它有如下基本特性。
(1)稳定性溶源性细菌通常很稳定,将整合到细菌DNA上的前噬菌体作为其遗传结构的一部分,随细菌DNA一起复制,一起分裂,能稳定遗传。
(2)免疫性溶源性细菌对同源噬菌体有高度特异的免疫性。其免疫是由于前噬菌体有c基因,能编码产生一种阻遏蛋白,阻抑噬菌体裂解基因等大部分基因表达,不复制DNA,不合成蛋白质,并抑制新进入细胞的相同噬菌体等病毒DNA的复制和结构蛋白的合成。 溶源性细菌中少数(10-5~10-3)前噬菌体阻遏蛋白的活性水平降低,自发脱
(3)裂解离细菌细胞染色体增殖,导致细胞裂解。这种现象称为溶源性细菌的自发裂解。经紫外线、X射线、氮芥、丝裂霉素C等理化因子处理发生高频率裂解的现象称诱发裂解。实验室常用这些理化因子诱导溶源性细菌产生噬菌体。这种中断溶源状态进入溶菌性周期的现象称为前噬菌体的切离,切离与整合过程相反,需要切离基因编码的切离酶。有极少数溶源性细菌的前菌体离开染色体,不进入增殖周期,就失去溶源性,称为溶源性细菌的复愈或非溶源化。
(4)溶源转变噬菌体DNA整合到细菌基因组中改变了细菌的基因型,使宿主细菌获得除免疫性以外的新遗传性状,称溶源性转变。某些细菌毒素、激酶的产生,抗原结构和血清型别可受溶源性控制。例如,白喉杆菌不产生毒素,当其被β-棒杆菌温和噬菌体感染而溶源化,由于后者带有毒素蛋白的结构基因(tox+),可编码毒素蛋白,因而变成产白喉毒素的致病菌。细菌失去该噬菌体即丧失产毒能力。又如,肉毒梭菌产生的肉毒毒素、某些链球菌产生引起猩红热的红斑毒素都与它们的溶源性细菌携带原噬菌体有关。我国学者发现在红霉素链霉菌中其P4温和噬菌体也有溶源转变活性,由它决定宿主红霉素的生物合成和形成气生菌丝的能力。溶源转变在微生物进化中有一定作用。细菌溶源性也是研究肿瘤病毒的一个好模式,因为这些病毒也有将其基因引入感染细胞产生肿瘤的能力。
溶源性细菌在发酵生产中危害极大。检验溶源性细菌的具体方法是将少量溶源性细菌与大量敏感性指示菌(溶源性细菌裂解后释放的温和菌体会发生裂解性周期者)混合,再加入琼脂培养基混匀倒平板。过一段时间溶源性细菌长成菌落。溶源性细菌分裂中有极少数个体自发裂解,释放的噬菌体不断侵染溶源性细菌菌落周围的指示菌,会产生中央有溶源性细菌小菌落、四周有透明圈的特殊噬菌斑(图8)。
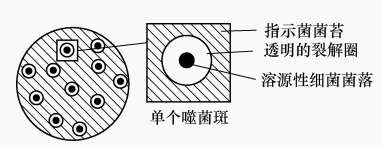
图8溶源性细菌及其特殊噬菌斑(模式图)
温和噬菌体可以三种状态存在(图9):①游离有感染性的病毒粒子;②前噬菌体整合进细菌染色体并一道复制;③营养期菌体在宿主细胞内指导病毒核酸和蛋白质合成。
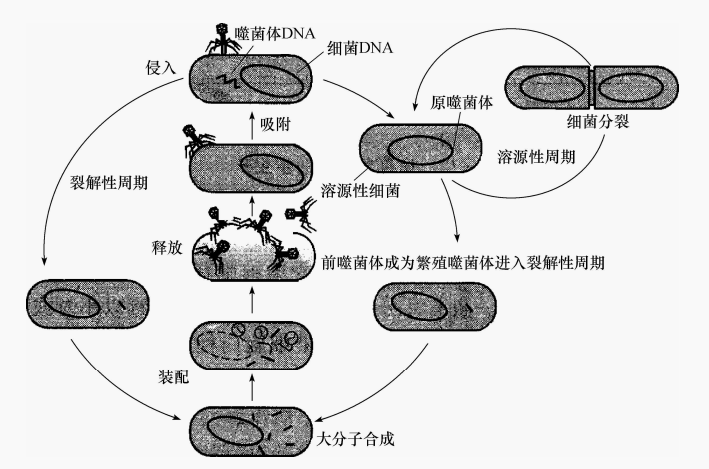
图9 温和噬菌体的生活周期
溶源性现象广泛存在于细菌中。卫星病毒感染也可导致其宿主细胞溶源化。
四、理化因素对病毒感染性的影响
病毒的化学组成是核酸与蛋白质,有的病毒有包膜。凡能破坏病毒成分和结构的理化因素均可使病毒失去感染性,即灭活。灭活的病毒仍保留其抗原性及血吸、血凝等活性。
(一)物理因素对病毒的影响
1.温度大多数病毒耐冷不耐热,离开机体后在室温中只能存活数小时。某些病毒如肝炎病毒和肠道病毒抵抗力较强,能在自然界中存活数日至数月。大多数病毒经加温60℃、30min即被灭活。但乙肝病毒需加热100℃、10min才能被灭活。病毒在低温下活性不易丧失,低温(-70~-20℃)是保存病毒活力的有效方法,可保存几个月。经冷冻干燥处理的病毒4℃可永久保存。有包膜病毒一般比无包膜病毒对温度敏感,反复冻融易被灭活。许多病毒有蛋白质和盐存在时较稳定。因此,在研制活疫苗时添加盐类有利于疫苗的保存。
2.辐射病毒对γ射线、X射线、紫外线等各种射线比较敏感,易变性、钝化,受直射日光和紫外线照射后即失去传染性。辐射钝化单链核酸的作用较强,能导致多核苷酸链的致死性断裂,对双链核酸仅有一条链断裂。紫外线对DNA的作用是使核酸邻近的嘧啶形成二聚体。但有些病毒如脊髓灰质炎病毒经紫外线灭活后再受可见光照射,激活修复酶可使灭活的病毒复活,故不能用紫外线制备灭活疫苗。紫外线可用于空气消毒。
(二)化学因素对病毒的影响
1.pH
一般病毒在pH6~9较稳定。常用5%苯酚等酸性或碱性消毒剂消毒病毒污染的器材和用具。保存病毒以中性或偏碱条件较好,常用50%中性甘油盐水保存含病毒组织块。
2.染料
某些染料可以穿透病毒,与核酸结合,当这些病毒遇到可见光时可被灭活。故病毒空斑实验中用中性红染色时需避光,否则病毒可被灭活不能形成空斑。
3.乙醚
乙醚等脂溶剂能溶解病毒包膜使病毒失去感染性。因此,包膜病毒对乙醚等脂溶剂敏感,裸露病毒对乙醚等脂溶剂有较强的抗性。可用乙醚来鉴别病毒是否具有包膜。
4.甲醛
甲醛可作用于病毒核酸,几乎所有病毒都能被甲醛灭活,但仍可保持其抗原性,故常用于疫苗生产。常用甲醛消毒污染了病毒的用具和空气。
5.其他药物
非离子型去污剂如NP40,阴离子去污剂如SDS及过氧化氢、漂白粉、高锰酸钾和过氧乙酸等氧化剂,碘和碘化物均有灭活病毒的作用。
五、病毒的非增殖性感染
病毒对敏感细胞的感染,并不一定都能产生有感染性的病毒子代。病毒感染宿主细胞并在其内完成复制循环,产生感染性的子代病毒,此类宿主细胞称该病毒的允许性细胞,此感染过程称增殖性感染。如果感染由于病毒或细胞的原因使病毒的复制在某一阶段受阻,会导致病毒感染的不完全循环。在此过程中病毒与细胞的相互作用可以导致细胞发生某些变化,甚至产生细胞病变,但在宿主细胞内不产生有感染性的病毒子代,称为非增殖性感染。
主要有以下三种类型。
1.流产感染
据发生原因分为依赖于细胞的流产感染和依赖于病毒的流产感染。如果病毒感染的细胞是病毒不能复制的非允许细胞,将导致依赖于细胞的流产感染。非允许细胞由于缺失某些参与病毒复制的酶、tRNA或细胞因子,仅有少数病毒基因表达,不能完成病毒复制。允许细胞和非允许细胞的划分是相对的,一种病毒的允许细胞可能是另一种病毒的非允许细胞,反之亦然,如猴肾细胞是病毒SV40的允许细胞,但人腺病毒感染猴肾细胞会发生流产感染。
依赖于病毒的流产感染由基因组不完整的缺损病毒引起,如干扰缺损病毒、卫星病毒等,它们虽然是包被在典型病毒壳体内的RNA,但只含有病毒核酸的部分基因,缺损少数病毒复制必需的基因,因此它们无论是感染非允许细胞还是允许细胞都不能完成复制循环。
有生物学活性的缺损病毒包括干扰缺损病毒、卫星病毒、条件缺损病毒和整合的病毒。干扰缺损病毒是病毒复制时产生的基因缺失的突变体,必须依赖同源的完全病毒提供其缺失基因的产物才能复制。卫星病毒的基因有缺失,必须依赖辅助病毒才能复制。条件缺损病毒是基因发生了突变的病毒条件致死突变体,在限制条件下导致流产感染。病毒整合感染的细胞没有感染性的病毒产生,只有在一定的条件下它才能转入复制,产生病毒颗粒。
2.限制性感染
这类感染因细胞的瞬时允许性产生,其结果或是病毒持续存在于受染细胞内不能复制,直到细胞成为允许性细胞病毒才能繁殖,或是一个细胞群体中仅有少数细胞产生病毒子代。例如,人乳头瘤病毒可感染上皮细胞,其早期基因的转录可在各分化期上皮细胞中进行,但晚期基因的转录只能在分化成熟的鳞状上皮细胞中进行,所以只有进入终末分化的鳞状上皮细胞病毒才能完成正常增殖。
宿主细胞形成自噬体是对病毒侵入和复制的另一种重要防御措施。自噬体是双层膜围成的囊泡结构,它捕获病毒并将其运到溶酶体降解。自过程通过识别受体信号启动天然免疫反应诱导干扰素合成,也可选择性地降解病毒感染形成的成分。
3.潜伏感染
在受染细胞内有病毒基因组长期存在,但并不产生感染性病毒颗粒,而且受染细胞也不会被破坏。这种携带病毒基因组但不产生感染性病毒的细胞称为病毒基因性细胞。例如,单纯疱疹病毒感染后在三叉神经节中潜伏,此时机体既无临床症状也无病毒排出;以后由于机体劳累或免疫功能低下等因素影响,潜伏的病毒被激活后沿感染神经到达皮肤、黏膜,发生单纯疱疹。潜伏感染的另一个极端情况是病毒基因的功能表达导致宿主基因表达的改变,以致正常细胞转化为恶性细胞,与溶源化过程相似。
六、病毒与宿主的相互作用
病毒是专性活细胞寄生物。它与宿主时刻都在相互作用。病毒为宿主细胞的外来异物,一方面,宿主对病毒感染表现出主动限制作用,努力抑制、消灭病毒,或使病毒潜伏处于隐性感染状态,保护宿主细胞免受病毒的侵犯;另一方面,病毒也积极对宿主细胞的核酸、蛋白质等主要大分子物质进行修饰、改造,以控制宿主细胞的代谢活动,使宿主细胞为病毒的感染和复制提供必需的场所、物质和能量。病毒进入宿主细胞后立即控制宿主的代谢活动,使宿主细胞大分子物质合成停止,并利用宿主细胞的大分子合成机制和能量装置大量复制病毒的核酸和蛋白质等;
同时给宿主细胞乃至宿主机体造成多方面的损害,甚至导致宿主细胞裂解。例如,许多噬菌体感染时都能产生关闭蛋白,能以不同方式抑制宿主大分子物质的合成,包括抑制宿主基因的转录和抑制宿主蛋白质及DNA的合成。许多菌体能编码某些酶破坏宿主细胞的限制性酶系统,保护病毒核酸。不同的菌体感染对宿主细胞的生物学效应差别很大,大多数较简单的噬菌体通常都不破坏宿主细胞DNA,对受感染细胞影响较小。有强致细胞病变效应的病毒对宿主细胞膜、细胞骨架等结构造成严重影响,最终都会导致细胞死亡。
参考资料
蔡信之,黄君红,康贻军.《微生物学(第四版)》.北京:科学出版社,2023.
敬请关注灰藻生物,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-06-28
#创作团队
编制人:木木 | 审稿人:小藻
