《厌氧菌培养技术指南》德国微生物保藏中心DSMZ:从原理到实操
来源:武汉市灰藻生物科技有限公司 浏览量:1506 发布时间:2025-06-22 22:36:07
引言
德国微生物菌种保藏中心 (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, DSMZ) 是全球领先、历史悠久的非营利生物资源中心之一,以其高标准、多样化的微生物菌种保藏和严谨的科学数据管理而闻名于世。DSMZ 不仅提供菌种资源,也致力于分享宝贵的微生物培养技术与专业知识。
厌氧微生物的培养是微生物学研究与应用中的关键环节,但也因其对氧气的高度敏感性而充满挑战。DSMZ 发布了一份详尽的《厌氧菌培养技术指南》,为科研人员和技术人员提供了从理论基础到实操细节的系统性指导。为提高厌氧菌培养技术,特此对 DSMZ 发布的《厌氧菌培养技术指南》进行编译与整理。本手册涵盖了厌氧菌特性、专用容器选择、无氧气体置换、碳酸氢盐缓冲培养基制备、还原剂使用、冻干菌种及活性培养物操作等核心内容,旨在为从事厌氧微生物培养的研究者、生产者和质量控制人员提供一份实用、权威的参考资料。
本实验室对于厌氧微生物的培养经验,基本来自对DSMZ相关指南的学习和邮件交流。感谢 DSMZ 提供的宝贵资源,并郑重声明,本手册大部分内容源自 DSMZ 官网(https://www.dsmz.de/),小部分来源于适用于本实验室的经验性总结,仅供学习交流之用。
厌氧菌培养技术指南
德国微生物菌种保藏中心(DSMZ)保藏有大量只能在厌氧条件下生长的细菌和古菌。根据我们的经验,厌氧菌或极端微生物培养的初学者在正确操作这些培养物时常常遇到困难。
本技术指南旨在,为所有计划开展厌氧菌研究的人员提供帮助。请仔细阅读,其中包含了关于厌氧菌培养最常见问题的解答!
本页内容涵盖以下主题:
8. 注释
1. 厌氧菌概述
广义而言,专性厌氧菌可定义为无法利用分子氧进行生长的微生物。根据其对氧气存在的耐受性,可进一步区分。
• 耐氧厌氧菌
仅在大气中存在显著浓度氧气时受到轻微抑制。例如,肠梭菌 (Clostridium intestinale) DSM 6191T 在常压空气环境下培养的琼脂平板表面也能生长良好。
• 另一个极端是严格厌氧菌
它们在暴露于低浓度氧气时即会死亡或立即停止生长。因此,在操作这类微生物的所有步骤中保持无氧条件至关重要。大多数严格厌氧菌不仅需要无氧环境以启动生长,还需培养基的氧化还原电位低于 -300 mV(即 Eh 值 < -300 mV)。该电位条件只能通过向培养基中添加还原剂来实现(详见“还原剂与刃天青”章节)。在这两种极端类型之间,存在各种适应性的中间类型。
大多数厌氧微生物营养要求苛刻,需要添加多种补充成分的复杂培养基。
在 DSMZ 菌株目录 (https://www.dsmz.de/catalogues/catalogue-microorganisms.html) 中,每种 DSM 菌株均推荐有特定的培养基编号。建议优先使用为各菌株推荐的培养基配方,这些培养基配方经过了培养验证,改用其他培养基可能导致生长延迟或完全失败。
使用厌氧菌株前,务必查阅其所需培养基配方并阅读相关培养文献。
DSMZ 提供的许多严格厌氧菌仅以活性生长培养物形式供应。我们推荐使用 Hungate 技术培养此类菌株。下文将简述该培养技术及其所需实验设备。关于 Hungate 技术的详尽描述可参考 Hungate (1969) 和 Wolfe (1971) 的综述,而 Breznak 和 Costilow (1994) 的文献则包含更广泛的厌氧培养信息。但请注意,即使有详细描述,某些厌氧培养操作步骤未经演示往往难以掌握。因此,对于厌氧微生物学初学者,最佳方式是前往已常规应用厌氧培养技术的实验室进行学习。
DSMZ 以冻干形式提供的厌氧菌株,通常对短暂暴露于低浓度氧气不敏感(即 非严苛厌氧菌)。例如,大多数梭菌 (Clostridium) 和硫酸盐还原菌属于此类(但并非全部)。若收到 DSMZ 提供的非严苛厌氧菌真空干燥样品安瓿瓶,也请参阅“真空干燥厌氧菌种的操作”章节的说明。
关于难培养微生物(如产甲烷菌或超嗜热菌)的进一步操作指南,敬请访问 DSMZ 官方网站获取。
2. 严格厌氧菌推荐培养容器
预还原培养基的适宜容器是成功培养严格厌氧菌的重要前提。为此,开发了特殊的玻璃器皿,可方便地实现完全的气密密封。其中,橡胶塞材质至关重要。只有丁基橡胶(butyl rubber)制成的塞子或隔垫才能有效阻止空气渗透进入容器。然而,注射针头反复穿刺塞子可能导致其透氧性增加。通常,塞子越厚,可重复使用的次数越多,同时保持其不透气性。
市售适用于厌氧培养的容器主要有两种类型(图 1):
• Hungate管:通过带有凸缘式丁基橡胶隔垫(flange-type butyl rubber septum)和开孔直径9mm的螺帽密封。该设计允许使用注射针头穿刺隔垫进行操作。
• Balch管:比Hungate管更坚固。若培养过程中可能产生2至3 bar(巴)的超压,推荐使用此类型。其采用厚丁基橡胶塞密封,并通过铝盖卷边(aluminium crimp)固定。密封和移除铝盖需使用专用工具(卷边器/开盖器)。
作为Balch管的替代品,也可使用各种规格的血清瓶(serum bottles)。然而,血清瓶的坚固性不及Balch管。若培养的菌株预计在培养过程中会产生大量气体(见下文),操作时须格外谨慎。
预还原培养基可在上述两种容器中,于室温避光条件下保存数周而不被氧化。
警告: 部分微生物在生长过程中会产生大量气体(例如梭菌通过发酵产气)。在密闭容器中生长时,产生的气体可导致显著超压。已知生长过程中会积累气体的菌株,应接种于液体培养基填充量不超过容器容积25% 的容器中进行培养。此外,对于生长快速的菌株,其培养物应至少每日排气一次以避免超压。操作可能存在超压的玻璃容器时,必须佩戴防护目镜!
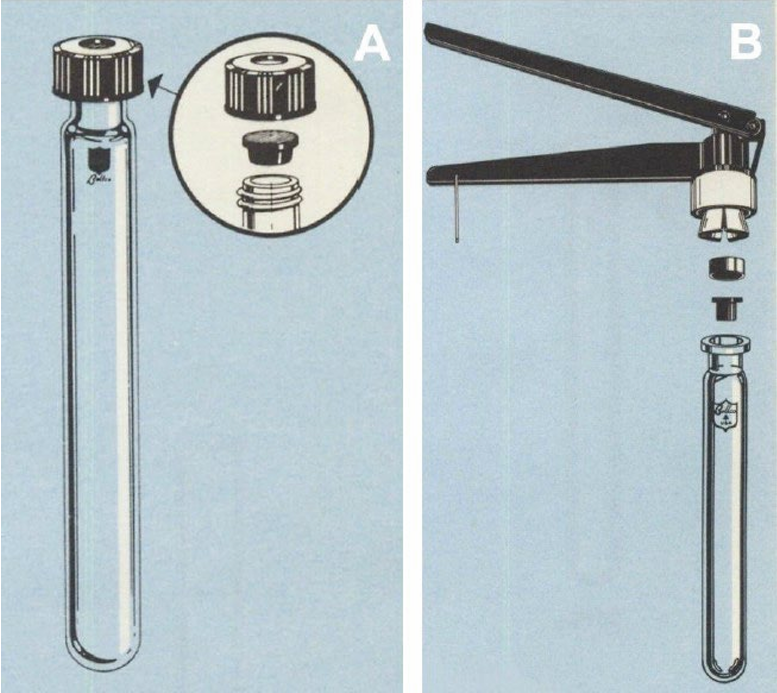
图 1、适用于严格厌氧菌培养的容器(A:Hungate管:带螺帽和丁基橡胶隔垫;B:Balch管:带丁基橡胶塞和用于固定塞子的铝盖卷边密封,密封容器需使用卷边器,图片由 Bellco glass 提供)
3. 使用无氧气体置换培养基与培养物中的气体
当开启装有预还原培养基或厌氧培养物的容器时,必须确保培养基液面上方持续通入无氧气体流,以避免其暴露于氧气中。所用无氧气体的成分应与培养基制备时使用的气体一致。我们推荐使用高纯度无氧气体(氧含量低于 5 ppm),通常以压缩气体钢瓶供应。高质量的无氧气体通常无需额外的除氧系统(例如加热铜柱),可直接用于培养多种厌氧菌。
Hungate 技术的核心是使用通气针(gassing cannulas)。通常,多根通气针通过丁基橡胶管(例如 Iso-Versenic)连接至一个分配歧管(manifold),歧管提供带超压的无氧气体,压力应调节至约 0.5 bar(巴)。至少需要两根通气针:一根用于待接种或待灌注培养基的容器,另一根用于提供接种物或待分装培养基的容器。若需对培养基或培养物进行无菌通气,可在玻璃注射器筒内填充棉花,并将其安装在通气针与丁基橡胶管之间(图 2A)。
组装完毕后,对填充棉花的玻璃注射器及针头进行高压灭菌,在 100°C 烘箱中烘干,冷却后连接至分配歧管。首次使用前,用无氧气体冲洗通气针约 15 分钟以驱除管内氧气,随后灼烧针头进行灭菌。
警告: 使用含 H₂ 的气体混合物前,必须确保经灼烧灭菌的针头已充分冷却。氢气(H₂)具有高度可燃性,即使仅接触高温表面也可能引发燃烧。对容器进行增压操作时,必须佩戴防护目镜!
使用 H₂ 或 H₂/CO₂ 混合气体对培养物进行增压时,应使用一次性无菌注射针头(内径 0.4 mm 或 27G),并如上所述连接填充棉花的玻璃注射器。为确保增压过程中注射器筒内压力恒定,需避免进气流量与出气流量失衡。可通过以下方法实现:用一根钢针(约 20G)穿刺注射器的橡胶塞,该钢针通过带 Luer-Lock 接头的适当阀门连接至橡胶管。将气体压力调节至所需值(多数情况下为 0.5 至 2 bar 超压)。倒置培养瓶,用注射针头穿刺已灭菌的隔垫(图 2B)。当针尖进入液体时,可观察到气体泡断续逸出,表明气体正流入培养基中。当气泡流速减缓,表明瓶内压力与外部供气压力达到平衡。气体流停止后,立即拔出通气针。
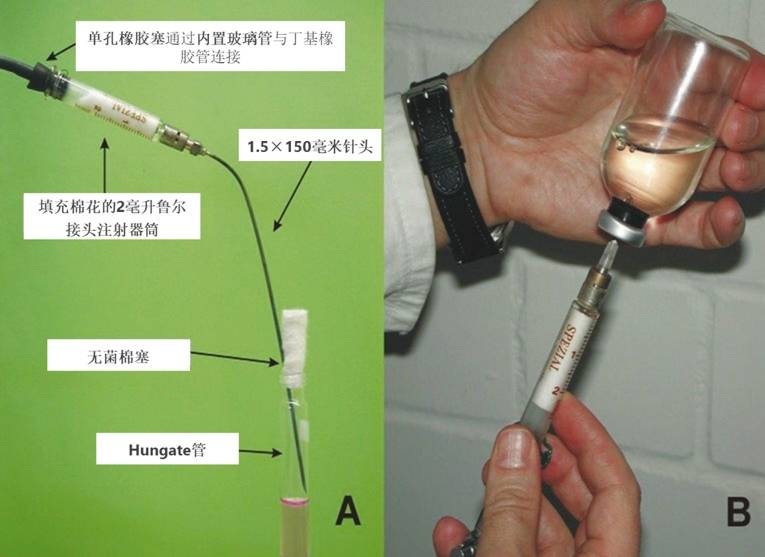
图 2、Hungate 技术中无菌通气针的组装(A:用于对开启容器进行无菌无氧气体置换的通气针;B:使用无菌气体混合物对厌氧培养物进行增压)
4. 碳酸氢盐缓冲无氧培养基的制备
在近中性pH条件下生长的厌氧微生物,通常需要缓冲培养基以维持适宜的pH值。否则,丁酸盐等发酵产物会导致培养基酸化,而例如氨化作用或硫酸盐还原作用则会导致碱化。
在100% N₂气体氛围下制备的培养基常含有生物缓冲剂(如HEPES或MOPS)以维持pH在合适范围。然而,对于营养要求苛刻的厌氧菌,HCO₃⁻/CO₂缓冲体系更为常用,因为许多厌氧微生物的生长需要CO₂。因此,若DSMZ菌种目录中培养基配方指定使用80% N₂/20% CO₂或80% H₂/20% CO₂气体氛围,则不可简单地用含生物缓冲剂且在100% N₂或100% H₂氛围下制备的培养基替代。
制备碳酸氢盐缓冲无氧培养基主要有两种方法:
1. 高压灭菌前添加固体碳酸氢盐/碳酸盐:
有时配方要求在高压灭菌前向无氧培养基中添加固体碳酸氢钠(NaHCO₃)或碳酸钠(Na₂CO₃)。此时,必须在固体完全溶解后检查培养基pH。若pH高于目标值,需持续通入含CO₂的气体混合物进行鼓泡通气(sparging),直至达到正确pH值。为防止高压灭菌过程中CO₂逸出容器及氧气接触液体,无氧溶液通常在密闭容器中进行灭菌。
警告: 密闭容器中的无氧溶液在高压灭菌时会产生高压,存在爆炸风险。为最大限度降低风险,密闭容器的灭菌仅限在配备温度传感器并能提供支持压力进行快速再冷却(辐射冷却)的高压灭菌器中进行。温度传感器必须置于参考容器内,该容器所装液体体积应与培养容器相同。此外,灭菌器必须设置为温度降至80°C以下方可开启。
2. 高压灭菌后添加无菌无氧储备液:
更推荐的方法是:在培养基高压灭菌后,添加在80% N₂/20% CO₂气体氛围下制备的无菌无氧碳酸氢盐/碳酸盐储备液。需加入培养基中的储备液量取决于多个因素(如培养容器中液体培养基与气相的比例),因此DSMZ培养基配方中提供的用量仅为粗略估计。通常,在80% N₂(或H₂)/20% CO₂氛围下制备的无机盐培养基,需添加30-40 mM NaHCO₃或15-20 mM Na₂CO₃才能将pH缓冲至约7.0。为确定达到特定pH值所需的NaHCO₃或Na₂CO₃储备液精确量,建议取一管已完成灭菌的培养基,分次添加小份量储备液(例如,每10 ml培养基添加0.1 ml 5% (w/v) Na₂CO₃储备液)。每次添加后,在保持无氧条件下取出少量培养基检测pH值。重复此步骤直至达到目标pH。随后即可将此确定的储备液量用于所有含相同体积培养基的容器。
5. 还原剂与刃天青
厌氧菌培养用培养基中通常包含一种氧化还原敏感染料(redox sensitive dye),用于监测氧化还原电位(Eh)。最常用的氧化还原指示剂是刃天青(resazurin),因其对微生物普遍无毒且有效浓度极低(0.5 至 1 毫克/升)。该指示剂染料处于失活态时呈深蓝色,首先需经历一个不可逆还原步骤生成试卤灵(resorufin)。在近中性pH条件下,试卤灵呈粉红色(碱性条件下可能变蓝)。当含有过量有机营养物的培养基煮沸数分钟,或无机盐培养基在无氧氛围下加热时,通常会发生此第一步还原。
在第二步可逆还原步骤中,试卤灵被还原为无色化合物氢化试卤灵(hydroresorufin)。试卤灵/氢化试卤灵氧化还原电对在电位低于约 -110 mV 时完全无色,当电位高于 -51 mV 时恢复粉红色。
请注意:
• 部分微生物要求氧化还原电位低于 -110 mV,因此即使培养基呈无色也可能无法启动生长。
• 培养基呈粉红色未必意味着其被氧气氧化(例如通过透气性橡胶隔垫)。例如,某些硝酸盐还原菌在生长过程中产生亚硝酸盐,后者作为强效氧化剂可能将电位提升至 -51 mV 以上。
大多数厌氧培养基需添加还原剂以降低并稳定氧化还原电位至最佳水平。
常用还原剂包括:
硫乙醇酸钠(sodium thioglycolate)、L-半胱氨酸盐酸盐(L-cysteine-HCl·H₂O)、九水合硫化钠(Na₂S·9H₂O)、无定形水合硫化亚铁(FeS, amorphous, hydrated)、二硫苏糖醇(dithiothreitol)和连二亚硫酸钠(sodium dithionite)。
硫乙醇酸钠常与抗坏血酸联用,主要用于部分传统厌氧培养基(如用于硫酸盐还原菌的Postgate培养基、DSMZ 63号培养基)。其优点是室温下相对稳定,可在无氧气体冲洗培养基前加入。仅在加热至100°C以上时被激活,此时能有效去除氧气。因此,在分装至无氧容器前,无需过度担心配制好的培养基暴露于氧气。这也是许多商品化培养基选用硫乙醇酸钠作为还原剂的原因。然而,硫乙醇酸钠的标准氧化还原电位(约 -100 mV)通常不足以满足大多数需要高度还原环境的严格厌氧菌的生长启动需求。
对于硫乙醇酸钠以外的还原剂,为达到最佳效果,其储备液应在氮气氛围下配制。配制过程中,避免将通气针插入液体,以免降低其还原能力。连二亚硫酸钠与氧气反应极快,必须溶于无氧水中并经过滤除菌。新配制的连二亚硫酸钠储备液在室温避光条件下仅可保存2-3周。
操作步骤:
1. 在高压灭菌后的培养基,临用前加入适当浓度的还原剂。
2. 静置培养基直至其变为无色(37°C保存可加速此过程)。
3. 若添加还原剂后培养基仍呈粉红色,应在无氧气体流下更换容器隔垫(可能已透氧)。
4. 最后,可加入少量连二亚硫酸钠将氧化还原电位最终调节至 -300 mV 以下。
5. 若上述措施无效,弃用该管培养基。
6. 真空干燥厌氧菌种的操作
DSMZ 提供的厌氧菌株冻干(冷冻干燥)培养物,仅以双安瓿包装(double-vial preparations)形式供应,并在真空下热封。双安瓿包装的优势在于:可有效防止单安瓿包装因真空突然释放可能产生的气溶胶污染环境;同时,流入的空气需通过内安瓿的无菌棉塞过滤,从而保护细胞沉淀免受污染。开启安瓿前,请根据内安瓿上的标签确认菌种信息(DSM 菌株编号及保藏日期),并检查外安瓿底部干燥剂颜色以确认真空状态。
注意: 自 2002 年 1 月起,DSMZ 已多次更换干燥剂指示颜色。2002 年前使用蓝色干燥剂,后改为红色,再改为黑紫色。当外安瓿受损、瓶内湿度升高时,指示颜色会发生变化:蓝色变粉红,红色变橙色,黑紫色变深红。
开启冻干厌氧菌安瓿后的所有步骤均必须全程维持无氧条件。
DSMZ 提供的多数厌氧菌株,其冻干菌体沉淀含有无定形硫化亚铁 (FeS) 以提供短期氧气保护,故沉淀呈黑色。然而,部分非严苛厌氧菌或产孢厌氧菌,在冻干前悬浮于脱脂乳中且未添加 FeS,因此其安瓿内为白色沉淀。
• 采用 Hungate 技术操作:
开启安瓿后,插入通气针使内安瓿持续处于无氧气流下。加入约 0.5 ml 推荐的无氧培养基至内安瓿,完全重悬细胞沉淀(有时需数分钟)。使用 1 ml 注射器配皮下针头(长度至少 38 mm)或经无氧气体冲洗的无菌巴斯德吸管转移细胞悬液。若使用巴斯德吸管,在接种转移期间,需开启装有适量培养基(5 至 10 ml)的 Hungate 管,并用第二根通气针持续通入无氧气体。
• 采用厌氧箱操作:
建议在厌氧箱外,用锋利锉刀在安瓿肩部中央(距尖端约 1 cm 处)刻痕。将刻痕的安瓿移入厌氧箱内,用锉刀或大镊子敲击安瓿尖端使其断裂。必要时,用纸巾包裹安瓿,并用锉刀或铅笔敲击以扩大开口,移除玻璃棉隔热层和内安瓿。轻轻提起棉塞,使用白炽火焰装置灼烧灭菌内安瓿上部(或用 70% 乙醇浸润的纸巾擦拭)。加入约 0.5 ml 无氧培养基重悬细胞沉淀,并将悬液转移至装有推荐培养基(5 至 10 ml)的容器中。如可能,应将重悬沉淀的最后几滴滴加至推荐培养基的琼脂平板或斜面上,以获得单菌落用于菌株纯度验证。
建议:
1. 除原液接种外,务必制备 1:10 和 1:100 稀释度的接种培养基。因冻干沉淀中的某些成分可能抑制首管生长,仅接种一管可能阻碍某些冻干菌株(如地杆菌属 Geobacter spp.)的成功复活。
2. 多数厌氧菌冻干培养物在复水后表现出延长的滞后期,应给予至少两倍于常规培养时间的培养周期,之后方可判定为无活性。
7. 活性生长厌氧培养物的操作
对厌氧培养物进行无菌注射取样时,推荐采用 Hungate 技术。该技术核心在于使用一次性注射器,其优势在于可在明确组成的无氧气体氛围中进行培养操作。图 3 展示了从 Hungate 管中无氧取样的过程。
操作步骤:
1. 隔垫灭菌: 在丁基橡胶隔垫上滴加乙醇,然后点燃进行火焰灭菌。
2. 排气(若需): 若预计瓶内因微生物生长(如发酵产气)存在超压,用无菌注射针头穿刺隔垫释放多余气体。
3. 注射器除氧: 取一支无菌一次性 1 ml 注射器,配 25G 至 23G 皮下针头(内径 0.50 至 0.65 mm)。使用无菌无氧气体或还原剂置换注射器死腔中的空气,使其达到无氧状态。
4. 气体置换防负压: 穿刺隔垫,向瓶内注入体积等于待取样体积的无氧气体(图 3)。此操作可防止后续取样时在培养管内形成负压。
5. 倒置取样: 将培养瓶倒置,用注射器吸取所需体积的液体样品。
6. 移出样品: 小心拔出针头和已吸取样品的注射器。
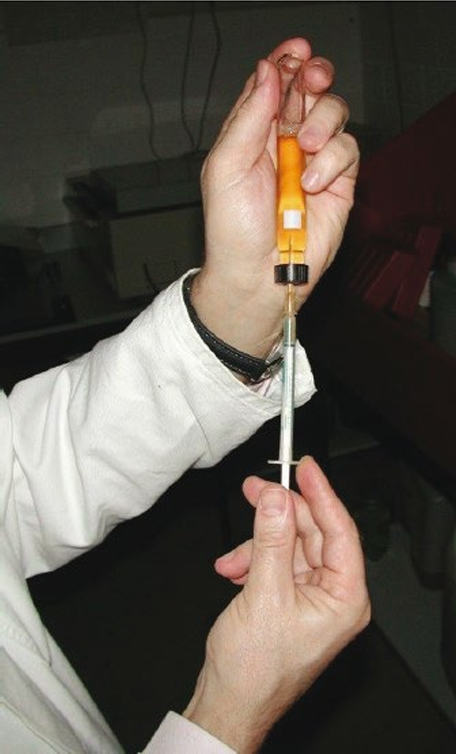
图 3、Hungate 管无氧取样示意图(穿刺隔垫,注入与后续取样体积等量的无氧气体至瓶内(防止形成负压);随后倒置培养瓶,吸取所需量液体;最后小心移出针头及注满液体的注射器)
8. 注释
1. 缩写说明 (化学物质、试剂及计量单位除外):
G = 规格 (Gauge - 用于针头等)
i.d. = 内径 (inner diameter)
2. 免责声明:
本文所含信息仅供参考,其依据为当前知识水平。微生物接收方须自行承担遵守现行法律法规的责任。DSMZ 对信息的准确性、充分性、可靠性或因使用信息造成的任何损失或伤害概不负责。
总结
本编译手册系统性地阐述了厌氧微生物培养的关键技术与操作规范,核心要点可概括如下:
1. 厌氧菌特性与分类: 明确区分了严格厌氧菌、耐氧厌氧菌和非严苛厌氧菌,强调了维持无氧环境和特定氧化还原电位(常需低于 -300 mV)对严格厌氧菌生长的重要性。
2. 专用培养容器: 推荐使用配备丁基橡胶密封的 Hungate 管或 Balch 管,确保气密性并防止氧气渗透。强调了操作产气菌株时的超压风险及安全措施(如限制装液量、定期排气、佩戴防护目镜)。
3. 无氧气体置换技术: 详细介绍了利用高纯度无氧气体(<5 ppm O₂)和 Hungate 通气针技术进行培养基及培养物气体置换、容器增压和取样的标准流程,重点在于维持无氧条件和压力平衡。
4. 碳酸氢盐缓冲培养基: 阐述了 HCO₃⁻/CO₂ 缓冲体系对许多厌氧菌的必要性,提供了两种制备无氧碳酸氢盐缓冲培养基的方法(灭菌前加固体盐或灭菌后加无菌无氧储备液),并强调了密闭灭菌的安全风险及严格的操作要求。
5. 还原剂与刃天青指示剂: 解释了刃天青作为氧化还原指示剂的变色原理(深蓝→粉红→无色)及其电位指示范围(约 -51 mV 至 -110 mV)。列举了常用还原剂(硫乙醇酸钠、L-半胱氨酸、硫化钠、连二亚硫酸钠等)的特性、使用场景、配制储存要求及添加到培养基的操作步骤,以达到并维持所需的低氧化还原电位(常低于 -300 mV)。
6. 冻干菌种操作: 详细说明了 DSMZ 双安瓿包装冻干厌氧菌种的检查、开启及复活流程,包括在 Hungate 技术或厌氧箱环境下的具体操作步骤、细胞沉淀重悬、转移方法以及纯度验证建议。强调了全程无氧操作、梯度稀释接种和延长培养时间的重要性。
7. 活性培养物操作: 重点介绍了使用 Hungate 技术进行无菌无氧取样的标准流程,包括隔垫灭菌、排气(如需要)、注射器除氧、等体积气体置换防负压、倒置取样等关键步骤。
本手册编译自 DSMZ 官方技术资料,凝结了DSMZ在厌氧微生物培养领域的深厚经验与最佳实践。这份详尽的指南将为国内微生物领域的科研人员、技术人员以在厌氧菌的分离、培养、保藏和应用研究中提供强有力的技术支持。如需厌氧菌培养相关的菌株、培养基或定制化服务,欢迎随时联系我们。
参考文献
1、https://www.dsmz.de/fileadmin/Bereiche/Microbiology/Dateien/Kultivierungshinweise/Kultivierungshinweise_neu_CD/engl_Anaerob_update.pdf/
2、布雷兹纳克 J.A., 科斯蒂洛 R.N. (Breznak, J. A., and Costilow, R. N.) 1994. 生长的理化因素 (Physicochemical factors in growth), pp. 137-154. 载于:P. 格哈特 (编) (P. Gerhardt (ed.)), 《普通与分子细菌学方法》 (Methods for general and molecular bacteriology). 美国微生物学会, 华盛顿 (American Society for Microbiology, Washington).
3、亨盖特 R.E. (Hungate, R. E.) 1969. 严格厌氧菌的滚管培养法 (A roll tube method for cultivation of strict anaerobes), pp. 117-132. 载于:J.R. 诺里斯, D.W. 里本斯 (编) (J. R. Norris and D. W. Ribbons (eds.)), 《微生物学方法》第 3B 卷 (Methods in Microbiology, vol. 3B). 学术出版社, 纽约 (Academic Press, New York).
4、沃尔夫 R.S. (Wolfe, R. S.) 1971. 微生物的甲烷形成 (Microbial formation of methane). 《微生物生理学进展》 (Adv. Microb. Physiol.) 6, 107-146.
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-06-22
#创作团队
编制人:小灰 | 审稿人:小藻
