质粒DNA的提取和纯化
来源:武汉市灰藻生物科技有限公司 浏览量:556 发布时间:2024-06-26 11:30:27
已经建立了多种从细菌中提纯质粒DNA的方法,这些方法无一例外都包括以下三个步骤:
培养细菌
收集和裂解细菌
纯化质粒 DNA
培养细菌
应尽可能从琼脂平板上挑取单菌落,接种到培养物中,再从中纯化质粒。通常,单菌落被接种到少量培养基中生长至对数生长后期。部分培养物可用来小量制备质粒DNA供分析用和(或)作为大量培养的接种物。大量培养物的生长情况主要依赖于质粒DNA的拷贝数以及其复制是松弛型抑或严紧型(见表1-3)。在所有情况下,细菌都应在某种选择条件下生长(如合适的抗生素)。
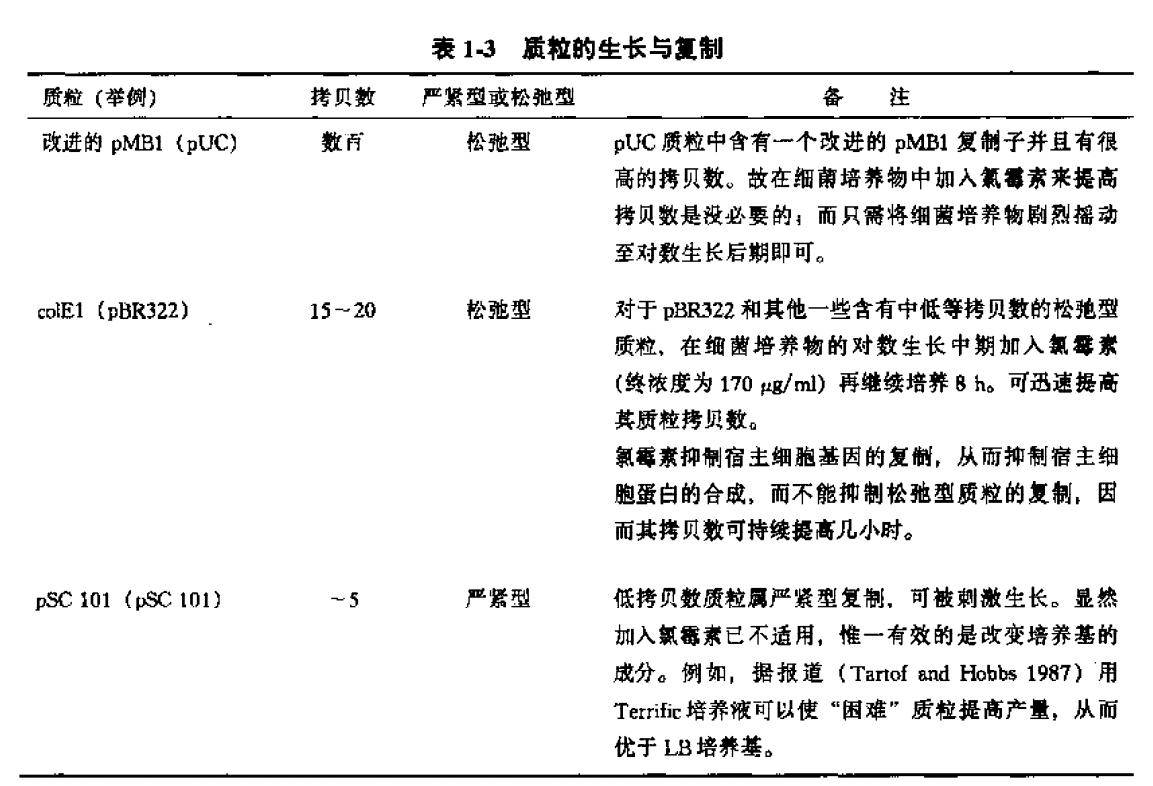
注;如上所述,现在的质粒都含有较高的拷贝数,因而已不再需要加入氯霉素来提高质粒的产量。但一些研究人员仍维续使用氯霉素,其目的不是用来提高质粒DNA的产量而是在大量培养时减少细菌量。在细菌培养物对数生长中期加入氯霉素可以避免在对大最细菌裂解物进行处理时所遇到的麻烦。由于有気霉素存在时,质粒(甚至高复制的质粒 pUC)的拷贝数得到…定程度的提高,因而加氣霉素的小细菌培养物和不加氣霉素的大量培养物所得到的质粒 DNA产盘可以相等
细菌的收获和裂解
细菌的收获可通过离心来进行,而细菌的裂解则可以采用多种方法中的任意一种这些方法包括用非离子型或离子型去污剂、有机溶剂或碱进行处理及加热处理等。选择哪一种方法取决子二个因素:质粒的大小、大肠杆菌菌株和裂解后用于纯化质粒DNA的技术。尽管针对质粒和宿主的每一种组合分别提出精确的裂解条件是不切实际的,但仍可根据下述一般准则来选择适当方法,以取得满意的结果。
大质粒(大于15kb)的处理应采用温和方法
质粒大于15 kb在细胞裂解操作时容易受损,故应采用温和裂解法从细胞中释放出来。通常将细菌悬于蔗糖等渗溶液中,再用溶菌酶和EDTA进行处理,破坏细胞壁然后加入 SDS等去污剂裂解球形体。
小质粒(小于15 kb)的处理可用较剧烈的方法
对小质粒进行操作时,可以用许多无需特殊处理的裂解方法。典型的方法是让细溶解物悬于去污剂中,通过煮沸或碱处理使之裂解。这些处理可破坏碱基配对,故可使宿主的线状染色体 DNA 变性。闭环质粒 DNA 链则由于处于拓扑缠绕状态而不能彼此分开。当条件恢复正常时,质粒DNA链迅速得到准确配置,重新形成完全的天然超螺旋分子。
超螺旋 DNA 长时间暴露于热或碱会导致不可逆变性(Vinograd and lebowit1996)。由此产生的环状卷曲DNA不能被限制酶切制、在琼脂糖凝胶中的迁移率大约是超螺旋DNA的2倍,用溴化乙锭染色时着色较弱,用碱或加热裂解细菌而制备的质粒中常可见到痕量的这种形式的DNA。
某些大肠杆菌菌株不能用加热的方法裂解
某些大肠杆菌菌株,尤其是HB101的一些变种和衍生物,在用去污剂或热裂解时可释放出相对大量的糖类,从而严重影响用氯化铯-化乙锭梯度平衡离心纯化质粒。糖类(密度为1.59)可在紧靠超螺旋质粒DNA的梯度处形成一致密而模糊的区带,于是很难避免糖类对质粒DNA的污染,而糖类可抑制多种限制酶的活性。故从诸如HB101和TG1等大肠杆菌菌株中大量制备质粒时,不宜使用沸法。
煮沸法也不适用于从表达内切核酸酶A的大肠杆菌菌株(endA*株,如HB101)中小量制备质粒。因为煮沸不能完全灭活内切核酸酶A,以后在Mg2*存在下温育(如用限制酶消化)时,质粒DNA会被降解。但通过一个附加步骤(用酚:氯仿进行抽提见纯化方案)可以避免此问题。
质粒DNA的纯化
分离质粒DNA的三种方法通常都存在一定量的RNA和大肠杆菌染色体DNA的污染。粗提的质粒DNA 可以通过琼脂糖凝胶电泳进行鉴定并且可以用来作为限制性内切核酸酶和 DNA聚合酶的模板和底物。然而,当对质粒的纯度有所要求时,如转染哺动物细胞所需的质粒,其污染必须被去除或至少降到可接受的水平。
近20年来,在学术文献中报道新的纯化方法的文章几乎每周发表一篇。尽管这些方法的优点已被它们的发明者所证实,但极少的方法被广泛接受。实际上,许多新方法都只是在旧方法的基础上作了少许改进或修改。一般来说,这些初始的旧方法已相当令人满意,并且仍有广泛的用途。
无论新旧,所有这些方法都适于纯化小的共价闭环结构的质粒DNA。而将共价闭环结构的质粒 DNA 与污染的细菌DNA片段分开的最经典的方法是C-澳化乙锭度密度离心(Clewell and Helinski1969)。目前这一方法依然被认为是判断其他方法的标准。这种分离方法取决于能与线状质粒DNA分子和闭环质粒DNA分子结合的化Z锭的量。在浓缩的盐溶液中溴化乙锭可以和DNA紧密结合。溴化乙锭插入碱基之间使双螺旋结构解开并使之延伸成两条线状的长链DNA或松弛的环状DNA分子(综述请见 Vinograd and lebowitz 1966)。闭环 DNA分子没有游离的末端,欲使之解开只能靠旋转。随着溴化乙锭分子越来越多地插入DNA,超螺旋结构的密度逐渐变大以致于阻止溴化乙锭分子的继续结合。而溴化乙锭与线状DNA的结合则不会被抑制,它继续与之结合直至饱和(通常每2.5个碱基结合一个溴化乙锭分子;Cantor and Schimmel1980)。与溴化乙锭结合使线状和闭环DNA的浮密度都降低。然而,由于线状DNA结合的溴化乙锭更多,它们在CC1-澳化乙锭梯度液中比闭环DNA有更低的浮密度(线状双链 DNA,1.54 g/cm³:闭环 DNA,1.59 g/cm³),因此在含饱和溴化乙锭的 CsCl 梯度液中闭环 DNA 比线状 DNA 处于更低的位置。
多年来,CsCL-澳化乙锭梯度平衡离心已成为制备大量质粒 DNA的首选方法。然而,该过程既费时(需3~5天)又需要昂贵的试剂和设备。现在,梯度平衡离心法主要用于纯化以下质粒:①纯化容易带上切口的特大质粒;②用于转染哺乳动物细胞的闭环质粒:③用于生物物理学测定的质粒。对于那些在酶切反应和分子克隆常规操作中用做底物和模板的小质粒(小于15kb),则用更加低廉和快捷的方法来纯化。这些纯化方法主要依赖于不同的沉淀反应,像离子交换色谱法或者从细胞核酸中分离质粒DNA的凝胶过滤层析法。
很多有效的质粒纯化试剂盒已经商品化。这些试剂盒包括用来吸附和洗脱质粒DNA的一次性色谱柱。有许多不同的基质,包括玻璃、硅土等,但最常用的是阴离子树脂如 DEAE(二乙氨乙基)或 QAE[二乙(2-羟丙基)氨乙基]。当然,同时具备必要的缓冲液、树脂和一次性柱子则更为方便。然而,由于试剂盒较为昂贵,应考虑是否有必要用昂贵的试剂盒替代任何一个实验工作者都可以轻易配制的试剂。用于常规实验的少量制备质粒 DNA当然不必使用试剂盒。在文献中所提到的上百种纯化质粒DNA的方法中,碱裂解法(Birnboim and Doly 1979;Ish-Horowiczand Burke 1981)因其简便、低廉和有效最为受欢迎。碱裂解法已经在成百个实验室的小量实验中成功应用了20 余年。对于大量制备,首选的方法是经碱裂解后用聚乙二醇分级沉淀质粒DNA(LiS1980;R.Treisman未发表),所得到的质粒DNA其纯度足以用于转染乳动物细胞酶切反应和 DNA测序。在某些需要超纯质粒DNA的情况下(如显微注射哺乳动物细胞),可以选用CsC-澳化乙锭梯度平衡离心法或适当的试剂盒。如果选用试剂盒,应在实验前详细阅读厂商的介绍和操作规程。
参考文献
(美)J.萨姆布鲁克 D.W.拉塞尔,分子克隆实验指南(第三版)(上册),科学出版社
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2024-06-26
#创作团队
编制人:木木
