质粒及复制
来源:武汉市灰藻生物科技有限公司 浏览量:1075 发布时间:2024-06-21 13:28:01
引言
质粒是染色体外的DNA分子,其大小范围在1kb至200kb以上不等。大多数来自细菌细胞的质粒是双链、共价闭合的环状分子,以超螺旋形式存在。
质粒:
已在形形色色的细菌类群中发现;大多数质粒的宿主范围较窄,只能生存于亲缘关系很近的少数细菌种类中。
是独立于细菌染色体之外进行复制和遗传的辅助性遗传单位。
已发展进化出多种机制以维持其在细菌宿主中的稳定的拷贝数,并将质粒分子精确地分配给子细胞。
其复制和转录或多或少依赖于宿主编码的酶和蛋白质。
常常含有一些编码对细菌宿主有利的酶的基因。这些基因可赋子宿主迴然不同的特征,其中不少具有重要的医学和商业价值。由质粒产生的表型包括对抗生素的抗性,产生抗生素、大肠杆菌素、肠毒素、限制酶与修饰酶,以及降解复杂的有机化合物等。
“质粒”(plasmid)一词由JoshuaLederberg于1952年提出,当时定义为染色体外的遗传单位。它曾一度被(episome)取代,该词由Jacob和Wolman(1958)提出,用以描述-种辅助性遗传单位,它能在细胞“附加体”之间传递,在胞质中或整合进宿主染色体中并作为其中的一部分进行复制传代。但是,在确定某些染色体外单位是否是质粒时遇到了困难。因为它们从不插入宿主染色体中,或者这些附加体插入频率极低。因此 Hayes(1969)建议附加体一词应该“服役期满、光荣退休"。现实并非如此:目前这两个词都在使用,而且二者的差别日渐模糊。不过,本章讨论的载体大多是由 Lederbezg所定义的质粒,而不是Jacob 和 Wolman 定义的附加体。因此对于追求严谨的读者,我们认为“质粒”通常比“附加体”更为准确,当然也有例外。
质粒的复制子决定其拷贝数
复制子是一个遗传单位,包括 DNA 复制起点及其相关的调控元件。在质粒中,复制起点是一段特定的 DNA片段,长约几百碱基对,其相关的顺式作用调控元件中含有参与DNA合成起始的由质粒或宿主编码的可扩散因子的结合位点。因此,质粒复制子可被定义为质粒DNA中能自主复制并维持正常拷贝数的一段最小的核酸序列单位。
1963年的冷泉港座谈会(Jacobetal.1964)中的一篇论文在解释细菌中环状的染色体外DNA分子可能的复制方式时首次使用“复制子”一词。此后,许多假设的原核生物模型被生物化学和遗传学实验所证实,复制子的概念延伸至包括原核生物和真核生物中的染色体及染色体外的复制单位。
在质粒中已鉴定的复制子已逾30个。但是,目前在分子克隆中常规使用的几乎所有的质粒都带有一个来源于MB1的复制子,该质粒最初是从一例临床标本中分离到的(Hershfield et al.1974)。带有该复制子[或亲缘关系与之十分接近的大肠杆菌E1(colE1)复制子(Balbaset al.1986)]的质粒在每个细菌细胞中可维持15-20 个拷贝。然而多年来,pMB1/coIE1复制子已经被大量改造以增加拷贝数,从而提高质粒DNA的产量。高拷贝数的质粒载体广泛应用于分子克隆及几乎所有小片段重组DNA(<15 kb)的常规操作中。相反,带有非pMB1/coIE1来源的复制子(表1-1)的低拷贝载体则用于某些特定目的,其中包括:①不稳定的DNA序列的克隆及在高拷贝数质粒增殖时具有致死效应的基因的克隆:②构建细菌人工染色体(BAC),即用于以大肠杆菌质粒的形式扩增大片段(~100kb)外源DNA的载体
质粒的复制
严紧型和松弛型复制
质粒拷贝数是指在正常生长条件下,每个细菌细胞或每条染色体所对应的平均质粒数。在质粒复制子的调控下,质粒拷贝数可随细菌培养条件的变化在一个较窄的范围内波动。生长条件恒定时,质粒增殖的速度与宿主细胞增殖的速度完全一致,拷贝数保持不变。
无论是质粒,还是其复制子,均能通过合理分配提供影响质粒 DNA合成起始频率的分子而维持其自身的复制与宿主增殖速率的协调。在携带pMB1/colE1复制子的质粒中,这种正向调节分子是一种RNA,被称为RNAⅡ,它被用作引发DNA前导链的起始合成。但是,其他复制子(如pSC101)的调节分子则是一种顺式作用蛋白(RepA)它对复制的起始具有正向作用,而对其自身基因的转录具有负调控作用(Linderetal1985;综述见Nordström 1990;Nordström and Wagner 1994;Helinskiet al.1996)。在任何情况下,正向调控的 RNA和蛋白质分子的合成和活性都受到辅助性的反式作用产物的调节,后者的浓度随质粒拷贝数或宿主菌的生理状态的变化而变化。
以 RNA分子为其正向调控分子的质粒通常具有高拷贝数,其复制不需任何质粒编码的蛋白质。相反,它们完全依赖于宿主提供的寿命较长的酶和蛋白质,包括分子伴佀、DNA聚合酶I和Ⅲ、DNA依赖的RNA聚合酶、核糖核酸酶H(RNaseH)、DNA促旋酶和拓扑异构酶I(综述见Helinskiet al.1996)。这些质粒以所谓的“松弛”方式进行复制,即使在蛋白质的合成因氨基酸饥饿(BazaralandHelinski1968)或添加抗生素如氯霉素(Clewell and Heinski1969)而受到抑制时(参见信息栏“氯霉素”),质粒复制仍不停止。由于蛋白质的合成为宿主 DNA每轮合成的起始所必需,而非质粒复制所必需,因此经氯霉素处理的细胞中质粒DNA的浓度相对于染色体DNA的量会有所增加(Clewel 1972)。经过几个小时的扩增,细胞中可能积累数千拷贝的松弛型质粒,最后质粒 DNA 可占细胞DNA 总量的50%甚至更多。相反地,像pSC101这类质的复制需伴随RepA蛋白的合成,因此一旦细胞蛋白质合成受阻,其拷贝数或产量均不能增加。这样的质粒被称为在“严紧”控制下复制的质粒。
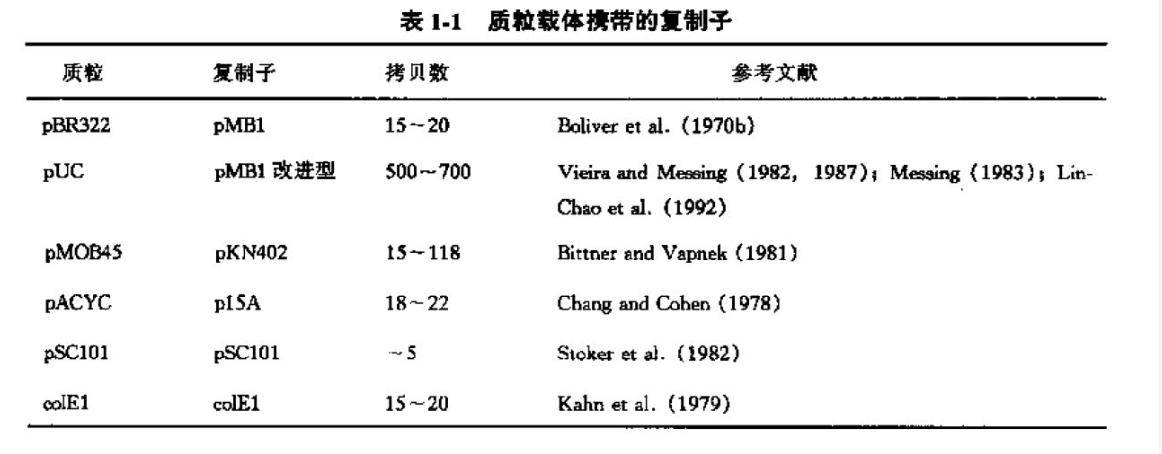
coIE1复制起点上DNA合成的起始以RNAII为引物
起始发生于含有复制所必需的所有顺式作用元件的600个核苷酸的区段。DNA前导链的合成以RNAⅡ(图1-1)为引物(综述见Eguchietal.1991)。
RNAⅡ前体的合成起始于其复制起点上游550bp处的启动子区,继而穿过复制起点,终止于下游大约150个核苷酸附近的一个位点。此约750个核苷酸的起始转录物的5'端折叠成复杂的二级结构,从而使RNAⅡ产生一个富G环,后者与位于模板链复制起点上游20个核苷酸处的质粒DNA富C区正好匹配。随后,该RNA转录产物由RNaseH加工为成熟引物,其切割位点位于复制起点内5个A序列中。所得的555个核苷酸的成熟RNAⅡ被DNA聚合酶I用作引物启动前导链的合成(综述及参考文献见Kies and Stahl 1989;Cesareni et al.1991;Helinskiet al.1996)。DNA-RNA稳定杂交体的延伸,暴露了DNA互补链上某些位点,后随链的不连续合成即在此处起始。因为后随链的合成在复制起点的上游约20个核苷酸处被RNAⅡ的非杂交片段封闭,因此在携带pMB1/colE1复制子的质粒中,复制过程按凯恩斯(Cairns)结构(或称0结构)无定向地进行。
RNAI是复制的负调节物
coIE1复制子不能影响质粒复制所必需的宿主酶的活性,因此,一旦DNA合成启动后,便不能改变其速度或进程。故而拷贝数的控制必须在DNA复制启动时或启动前进行。质粒 DNA的合成依赖于复制起点处稳定的DNA-RNAⅡ杂交体的形成。正常情况下,复制的起始是由正确折叠与不当折叠的RNAI间相互转化的平衡来控制的,前老可形成稳定的杂交体,后者则不能。
这一平衡的改变主要由RNAI来控制,RNAI是由RNAI基因的反义链编码的108个碱基小分子转录物。它折叠成可与新生RNAⅡ前体结合的三叶草结构,从而阻止后者折叠成形成稳定杂交体所必需的二级结构(Lacatenaand Cesareni 1981)。
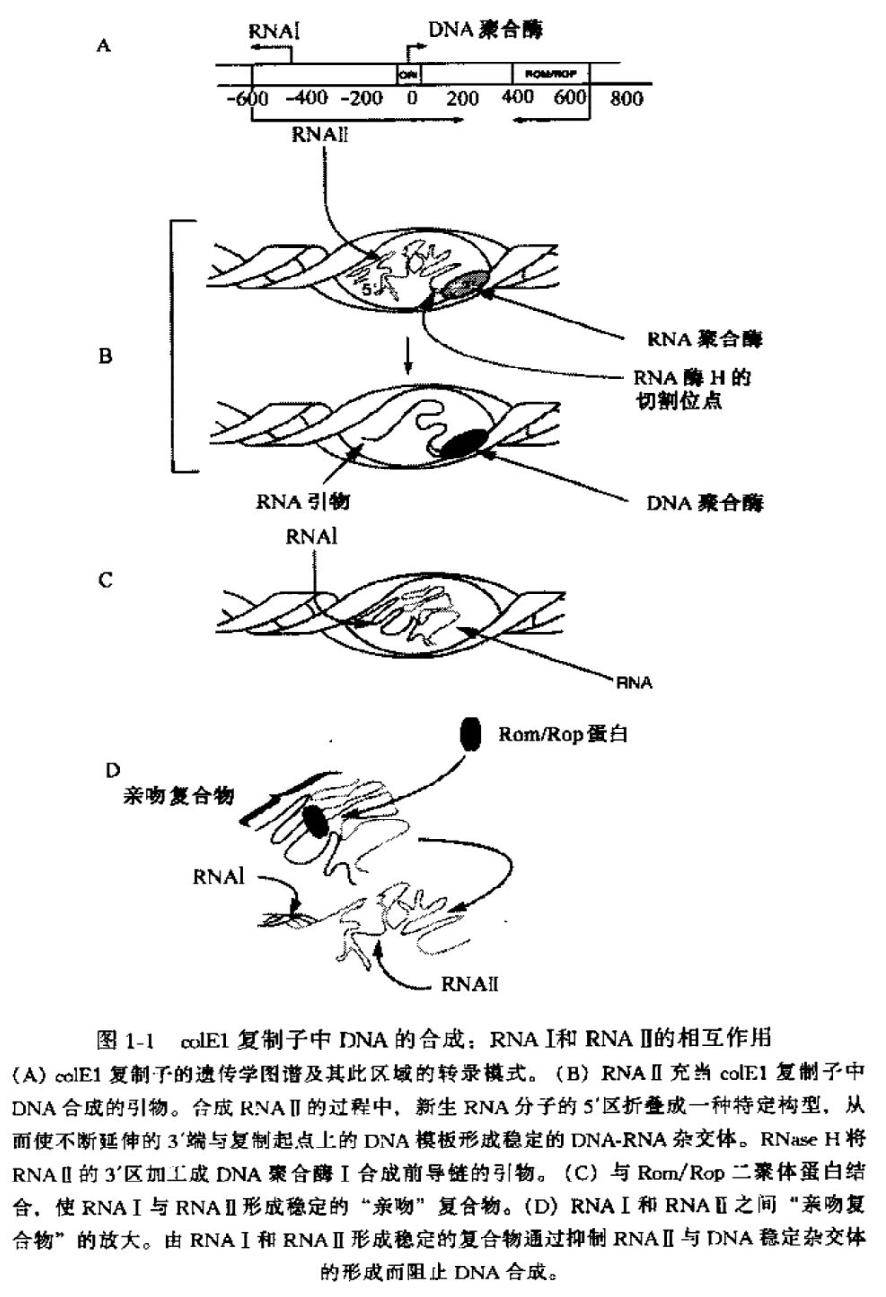
RNAI与RNAI相互作用的机制曾由Tomizawa及其同做过详细阐述(Tomizawa 1990a)。图中显示RNAI与RNAⅡ短寿命折叠中间体间的一种动力学相互作用。当新生RNAⅡ转录物的长度在80~360个核苷酸之间时,其折叠特别容易受到RNAI的干扰。结合首次发生于这两个RNA分子的茎环结构,导致RNAI的5'区与全程RNAI形成一段双链RNA。因此,RNAI作为质粒DNA合成起始的负调节物控制质粒拷贝数。
pUC质粒家族的拷贝数远远高于携带pMB1或colE1复制子的其他质粒的拷贝数。这是由于pUC质粒带有一个点突变,可依温度不同改变正调节分子(RNAⅡ)的二级结构。在37℃或42℃下,RNAD似乎折叠成抗RNAI抑制的构型。于是DNA合成的起始加强,结果拷贝数特别高。当细菌生长子30℃时,pU℃质粒的拷贝数恢复正常(Lin-Chap etal.1992)。
解释维持质粒拷贝数的最简单假说是胞质内RNAI的稳态浓度是由基因剂量决定的(Tomizawa1987;Chiang and Bremer1991)。如果质粒的拷贝数高出正常值,RNAI的浓度便上升,质粒 DNA的复制受抑制。不过只有RNAI的半衰期较短(Pritchard1984)和RNAI的降解速率与细萌的生长速率成比例时,质粒接贝数与抑制剂浓度波动之间的这种关联才能发生。在细胞的正常生长条件下,这两种情况似乎都会发生,此时RNAI的半衰期为1-2min。动力学计算显示这一时期足够短,以至该分子可以作为质粒拷贝数的实时监测器(Brendeland Perelson 1993)。
RNAI的降解过程分为两个阶段。首先,由RNaseE将其5'端的5个核苷酸切除所形成的截短分子仍能与RNAI结合,但易被一种核糖核酸酶降解,该酶的活性对生长速度敏感(Lin-Chao and Cohen 1991)。此种调节提供了维持恒定质粒拷贝数的机制即使在细胞呈间歇式生长时亦不例外。
ROM/ROP蛋白对RNAI负调节活性的调控
由质粒编码的--种被称为ROM(RNAImodulator)或R()P(repressor of primer)的蛋白质可提高RNAT与RNAI结合的效率。ROM蛋白通过促进RNAT和RNAⅡ杂交体的形成,增强RNAT的负调节作用。因此,rom/rop基因缺失至少可使c0IE1质粒拷贝数提高两个数量级(TwiggandSherratt1980)。例如,rom/rop基因的缺失可使较早期组建的载体pBR322在每个细细胞中的质粒拷贝数从15-20个增至500个以上,在 rom/rop基因中插入一段外源DNA片段,则可导致致死性的大量质粒DNA复制(Giza and Huang 1989)。
ROM 是含有63个氨基酸的多肽的同型二案体,它由位于coIE1复制起点下游400个核苷酸处的一个基因所编码(Twigg and Shertatt 1980;Tomizawaand Som 1984)。该二聚体每个亚单位含有由一个转角连接的两个。螺旋,因而此二聚体是由4个a螺旋组成的呈双重对称的紧密束状结构(Bannerera.1987)。ROM蛋白与RNAI和 RNAⅡ具有相似的亲和力(Helmer-Citrerichetal.1988),它促使这两种RNA分子的互补结合物由不稳定的中间体变为更稳定的结构(Lacateneclal.1984:TomizewaandSom1984:Tomizawa1990b)。很可能 ROM 蛋自两个亚单位中的任何一个都能识别 RNAI和RNA日中的序列和结构元件。ROM蛋白与RNA相互作用时形成的茎相结合,从而稳定“亲吻”复合物(Tomizawa1985)并起始RNAI-RNAI完美杂交体的形成(Ekuchi andTomizawa 1990)。
质粒的不相容性
利用同一复制系统的两个质粒会在复制和随后向子细胞的分配过程中彼此竞争,这样的质粒在细菌培养物中不能和平共处。这种现象称之为不相容性(综述见Davison1984:Novick 1987)。
携带相同复制子的不同质粒属于同一不相容组,它们不共存于同一细菌中,带有不可互换成分的复制子的质粒则属于不同的不相容组,它们可以共存于同一细菌中。例如p15A、R6K和F便是与cIE1型质粒相容的质粒。
携带相同复制子的质粒是从细胞内的质粒库中随机选取出来进行复制的。但是,这并不能确保两个不同质粒在一个菌落中的拷贝数总能保持相同。例如,较大的质粒比较小的质粒需要更多的复制时间,因而在同一菌落的每个细胞中其选择地位处于劣势。即使质粒的大小相似,也可能不相容,这是因为在各个细菌细胞中来自随机过程的复制起始效率是不平衡的。这种不平衡可以很快导致两种质粒在拷贝数上严重失衡。在一些细胞中,一种质粒处于绝对优势;而在另一些细胞中,与之不相容的另一种质粒却占尽上风。在无选择条件下,细菌生长几代之后,占少数的质粒可能在菌落的某些细胞中丧失殆尽。在原始细胞的后代中可含有两种质粒中的任意一种,但极少兼而有之。
将质粒DNA片段导入无关的多拷贝复制子中并检测待试质粒共存于杂交体的能力,可以鉴定是否是质粒DNA的该区段产生不相容性。例如,严紧低拷贝数质粒pSC101的不相容基因座位于复制起点中以约20bp为单位的多次正向重复区,即所谓重复子(iteron)。重复子似乎与邻近的顺式作用的par基因座一起,通过封闭由质粒编码的 RepA 蛋白将质粒 DNA分子“铐”起来,从而阻止其对宿主编码的蛋白质与复制起点结合的诱导(综述见Nordström 1990)。相反,对于前已述及的coIE1,其不相容性是由RNAI的抑制活性决定的(综述见Novick1987)。在RNAI上为等位基因且用于调控复制的任何两个不同质粒是不相容的,无论它们是否具有其他相同功能(Tomizawa and ltoh 1981)
如前所述,目前所用的大多数载体均带有来自pMB1质粒的复制子。这些载体与其他携带coIE1复制子的所有质粒均是不相容的,但与带有重复子结合复制子的质粒,如pSC101及其衍生物则是完全相容的。表1-2列出了几种常用质粒及其复制的负调控元件。

(美)J.萨姆布鲁克 D.W.拉塞尔,分子克隆实验指南(第三版)(上册),科学出版社
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2024-06-21
#创作团队
编制人:木木
