从入门到精通02:微生物培养篇,微生物营养转运机制
来源:武汉市灰藻生物科技有限公司 浏览量:80 发布时间:2026-01-21 09:42:40
微生物常生活在营养贫乏环境中,它们必须能够将营养物质从溶液转运到细胞内,甚至逆浓度梯度进行。此外,营养分子须穿过选择性通透的质膜,该膜阻止大多数物质自由通过。
鉴于营养物质种类繁多,微生物采用几种不同的转运机制。
其中最重要的是,促进扩散 facilitated diffusion、主动运输 active transport和基团转位 group translocation。
真核微生物似乎不采用基团转位,而通过胞吞作用 endocytosis摄取营养物质。
被动扩散 Passive Diffusion
少数物质,如甘油,可通过被动扩散 passive diffusion穿过质膜。被动扩散通常简称为扩散,指分子从高浓度区域,向低浓度区域移动的过程。
扩散速率取决于细胞内外的浓度梯度差,需要相当大的浓度梯度,才能充分摄取营养物质。
水、氧气和二氧化碳等小分子,通常通过被动扩散穿过膜。大分子、离子和极性物质,须通过其他机制进入细胞。
促进扩散 Facilitated Diffusion
通过嵌入质膜的载体蛋白 carrier proteins(有时称为透性酶 permeases),可提高跨选择性通透膜的扩散速率。涉及载体蛋白的扩散称为促进扩散 facilitated diffusion。
促进扩散与被动扩散相比,可在更低的分子浓度下,以更快的速率,随浓度梯度增加。当载体饱和时,扩散速率趋于平稳,或达到平台期。
曲线类似于酶-底物曲线,载体蛋白对要转运的物质,也具有特异性,每种载体只转运相关溶质。
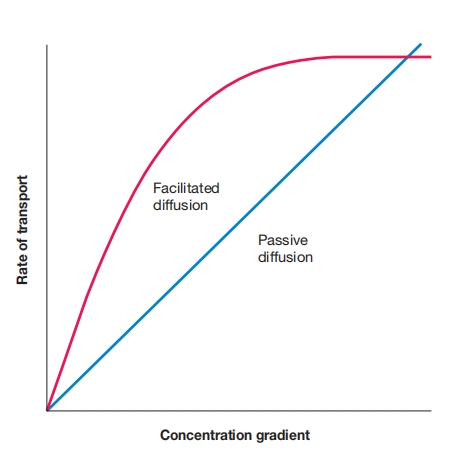
被动扩散与促进扩散:当促进扩散载体运行时,在特定梯度值以上,出现饱和效应或平台期。只要载体蛋白参与转运,就会看到这种饱和效应。
尽管涉及载体蛋白,促进扩散确实是真正的扩散。跨膜的浓度梯度驱动物质运动,不需要代谢能量输入。如果浓度梯度消失,净向内运动停止。
可通过将转运的营养物质,转化为另一种化合物来维持梯度。在真核细胞中,一旦营养物质进入,可通过将营养物质移动到另一个膜状区室来维持梯度。
某些透性酶与主要内在蛋白 major intrinsic protein(MIP)家族相关。MIP促进小极性分子扩散,几乎在所有生物体中都有观察到。
细菌中最普遍的两种MIP通道是水通道蛋白 aquaporins,负责水转运。其他重要MIP是甘油促进因子 glycerol facilitators,辅助甘油扩散。
尽管对促进扩散机制已做了大量研究,但该过程尚未完全理解。载体蛋白复合物似乎跨越膜。
溶质分子与外部结合后,载体可能改变构象并在细胞内部释放分子。随后载体恢复原始形状,准备拾取另一个分子。
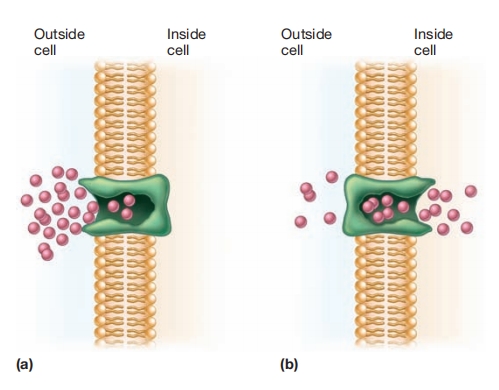
促进扩散模型:(a)膜载体在结合外部分子后可改变构象,随后在细胞内部释放该分子。(b)然后它返回向外定向位置,准备结合另一个溶质分子。因为没有能量输入,只要外部浓度更高,分子将继续进入。
净效应是亲水分子可根据其浓度梯度进入细胞。该机制由浓度梯度驱动,因此是可逆的。如果溶质在细胞内部浓度更高,它将向外移动。由于细胞代谢进入的营养物质,向内流动受到促进。
尽管许多细菌通过促进扩散转运甘油,但该机制似乎不是主要摄取机制。这是因为营养物质浓度通常在细胞外部较低。促进扩散在真核细胞中更为显著,用于转运各种糖类和氨基酸。
主动运输 Active Transport
由于促进扩散,只能在胞外溶质浓度较高时发生,微生物必须具有能逆浓度梯度移动溶质的转运机制,因为微生物常生活在营养稀薄的环境中。
微生物在这种情况,使用两种方式转运:主动运输 active transport和基团转位 group translocation,两者都依赖能量。
主动运输是在代谢能量输入下,将溶质分子,逆浓度梯度转运的过程。主动运输涉及透性酶,它在某些方面类似于促进扩散。这些透性酶对转运分子具有高度特异性。
相似溶质分子,可在促进扩散和主动运输中竞争同一载体蛋白。主动运输也以高溶质浓度下的载体饱和效应 carrier saturation effect为特征。
尽管如此,主动运输在使用代谢能量和浓缩物质能力方面与促进扩散不同。
阻断能量产生将抑制主动运输,但不会立即影响促进扩散。
ATP结合盒转运蛋白 ATP-binding cassette transporters(ABC转运蛋白 ABC transporters),是主动运输系统的重要例子。它们在细菌、古菌和真核生物中均有观察到。
通常这些转运蛋白,由两个疏水跨膜结构域组成,其胞质表面与两个ATP结合结构域关联。跨膜结构域在膜中形成孔道,ATP结合结构域结合并水解ATP以驱动摄取。
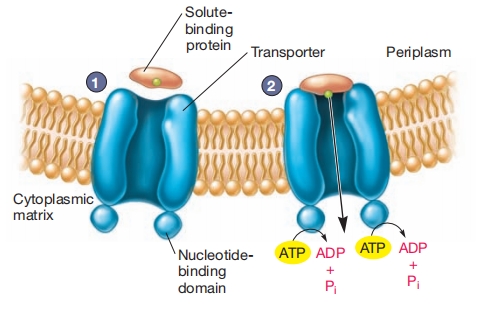
ABC转运蛋白功能。(1)溶质结合蛋白结合要转运的底物并接近ABC转运蛋白复合物。(2)溶质结合蛋白附着到转运蛋白上并释放底物,底物在ATP水解辅助下穿过膜。
ABC转运蛋白使用特殊底物结合蛋白,位于革兰氏阴性菌的周质空间,或附着在革兰氏阳性菌质膜外表面的膜脂上。这些结合蛋白结合要转运的分子,然后与膜转运蛋白相互作用将溶质分子移入细胞内。
大肠杆菌通过此机制转运多种糖类,它们也可使用多药抗性ABC转运蛋白 multidrug-resistance ABC transporter,将抗生素泵出。
进入革兰氏阴性菌的物质,必须先穿过外膜,然后ABC转运蛋白和其他主动运输系统才能发挥作用。
有几种方式可以实现这一点。当物质较小时,可使用通用孔蛋白 porin protein(如OmpF,外膜蛋白)。
大肠杆菌磷酸盐摄取系统提供了小分子穿过外膜运动的例子。无机磷酸盐通过孔蛋白通道穿过外膜。然后,两个转运系统之一将磷酸盐穿过质膜。使用哪个系统取决于磷酸盐浓度。
PIT系统在高磷酸盐浓度下发挥作用。当磷酸盐浓度低时,称为PST(磷酸盐特异性转运)的ABC转运系统使用周质结合蛋白将磷酸盐带入细胞。
与磷酸盐等小分子不同,较大分子(如维生素B12)的转运需要使用专门的高亲和力外膜受体,这些受体与质膜中特定转运蛋白协同作用。
能量保存过程中的电子传递产生质子梯度(在原核生物中,质子在细胞外浓度高于内部)。质子梯度可用于细胞工作,包括主动运输。
大肠杆菌乳糖透性酶 lactose permease对乳糖的摄取是一个经过充分研究的例子。该透性酶是单一蛋白质,当质子同时进入细胞时,将乳糖分子向内转运。
这种两种物质在同一方向的连锁转运称为同向转运 symport。此处,以质子梯度形式的能量驱动物质转运。
尽管转运机制尚未完全理解,X射线衍射研究表明转运蛋白以向外和向内构象存在。当乳糖和质子结合到向外构象上的不同位点时,蛋白质转变为向内构象。然后糖和质子被释放到细胞质中。
大肠杆菌也使用质子,同向转运摄取氨基酸和有机酸(如琥珀酸和苹果酸)。
质子梯度也可间接驱动主动运输,通常通过形成钠离子梯度。例如,大肠杆菌钠转运系统在质子向内运动响应下将钠泵出。这种转运物质向相反方向运动的连锁转运称为反向转运 antiport。
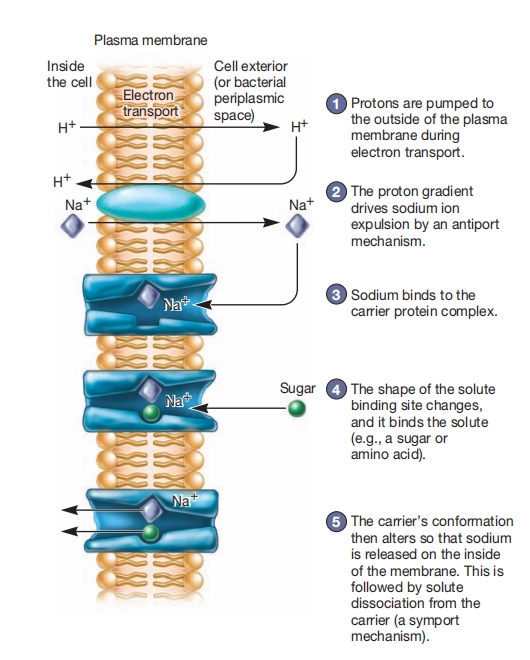
利用质子和钠梯度的主动运输。1. 电子传递过程中质子被泵到质膜外侧。2. 质子梯度通过反向转运机制驱动钠离子排出。3. 溶质结合位点形状改变,结合溶质(如糖或氨基酸)。4. 钠结合到载体蛋白复合物。5. 载体构象改变,使钠在膜内侧释放,随后溶质从载体解离(同向转运机制)。
由这种质子反向转运系统产生的钠梯度随后驱动糖类和氨基酸的摄取。虽然机制尚未完全理解,但认为钠离子附着到载体蛋白上,使其改变形状。然后载体紧密结合糖或氨基酸,并将其结合位点朝向细胞内部定向。
由于低细胞内钠浓度,钠离子从载体解离,其他分子随之解离。大肠杆菌转运蛋白在钠同时向内移动时携带糖蜜二糖 melibiose和氨基酸谷氨酸 glutamate。
钠同向转运 sodium symport或共转运 cotransport也是真核细胞中的重要过程,用于糖和氨基酸摄取。然而,在真核细胞中,ATP通常而非质子动力驱动钠转运。
微生物通常对每种营养物质有多个转运系统,如大肠杆菌所示。这种细菌至少有五种半乳糖 galactose转运系统,三种谷氨酸 glutamate和亮氨酸 leucine氨基酸系统,以及两个钾转运复合物。
当同一物质有多个转运系统时,这些系统在能量来源、对转运溶质的亲和力和调节性质等方面有所不同。这种多样性使微生物在变化环境中具有额外竞争优势。
基团转位 Group Translocation
在主动运输中,溶质分子在不修改情况下穿过膜。另一种称为基团转位 group translocation的转运类型在将分子带入细胞时对其进行化学修饰。基团转位是一种主动运输,因为摄取分子时使用代谢能量。
这在最著名的基团转位系统磷酸烯醇式丙酮酸 phosphoenolpyruvate:糖磷酸转移酶系统 phosphotransferase system(PTS)中得到清晰证明,该系统在许多细菌中观察到。PTS转运多种糖类,同时使用磷酸烯醇式丙酮酸(PEP)作为磷酸供体对它们进行磷酸化。
PEP + 糖(外) → 丙酮酸 + 糖-磷酸(内)
PEP是许多化能有机异养菌 chemoorganoheterotrophs用于从有机能源提取能量的生化途径中的重要中间体。PEP是高能分子,可用于合成ATP(细胞能量货币)。然而,当用于PTS反应时,PEP中的能量用于激活摄取而非ATP合成。
PEP向进入分子的磷酸转移涉及几种蛋白质,是磷酸接力系统 phosphorelay system的一个例子。在大肠杆菌和沙门氏菌中,PTS由两种酶和一种低分子量热稳定蛋白(HPr)组成。
HPr和酶I enzyme I(EI)位于胞质中。酶II enzyme II(EII)在结构上变化更大,通常由三个亚基或结构域组成。EIIA位于胞质中且可溶。EIIB也是亲水的,通常附着在EIIC(一种嵌入膜中的疏水蛋白)上。
磷酸从PEP通过酶I和HPr辅助转移到酶II。然后,糖分子在通过酶II穿过膜时被磷酸化。酶II只转运特定糖类,随PTS不同而变化,而酶I和HPr对所有PTS通用。
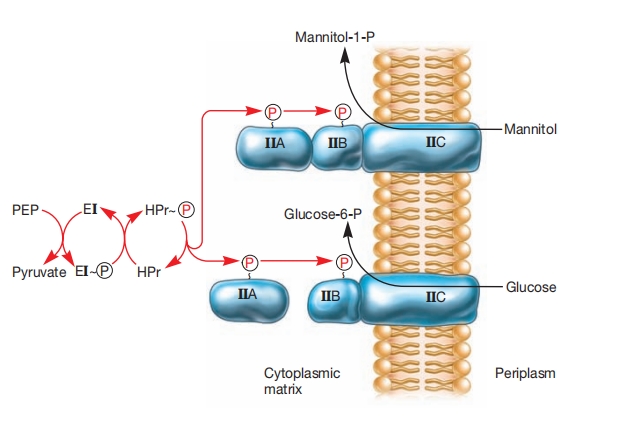
基团转位:细菌PTS转运。展示了磷酸烯醇式丙酮酸:糖磷酸转移酶系统(PTS)的两个例子。系统涉及以下组分:磷酸烯醇式丙酮酸(PEP)、酶I(EI)、低分子量热稳定蛋白(HPr)和酶II(EII)。高能磷酸从HPr转移到可溶性EIIA。在甘露醇转运系统中,EIIA附着在EIIB上;在葡萄糖系统中,EIIA与EIIB分离。无论哪种情况,磷酸都从EIIA移动到EIIB,然后在通过膜转运时转移到糖上。EII组分之间可能存在其他关系。例如,IIA和IIB可能形成与膜复合物分离的可溶性蛋白;磷酸仍从IIA移动到IIB,然后到膜结构域。
PTS在细菌中广泛分布。埃希氏菌属、沙门氏菌属、葡萄球菌属大多数成员,以及许多其他兼性厌氧菌 facultatively anaerobic bacteria(在有无O2条件下均能生长的细菌)具有磷酸转移酶系统;一些专性厌氧菌 obligately anaerobic bacteria(如梭菌属Clostridium)也有PTS。
然而,大多数好氧细菌(除了一些芽孢杆菌属Bacillus物种外)似乎缺乏PTS。许多碳水化合物通过PTS转运。大肠杆菌通过基团转位摄取葡萄糖、果糖、甘露醇、蔗糖、N-乙酰葡糖胺、纤维二糖和其他碳水化合物。
除了在转运中的作用外,PTS蛋白可结合化学引诱物,细菌通过趋化性 chemotaxis过程向这些物质移动。
铁摄取 Iron Uptake
几乎所有微生物都需要铁用于细胞色素和许多酶。铁摄取因高铁铁 ferric iron(Fe³⁺)及其衍生物的极端不溶性而变得困难,这使得可用于转运的游离铁很少。
许多细菌和真菌通过分泌铁载体 siderophores[希腊语意为铁载体]克服了这一困难。铁载体是低分子量有机分子,能与高铁铁形成复合物并将其供应给细胞。这些铁转运分子通常是羟胺类 hydroxamates或酚盐-邻苯二酚盐 phenolates-catecholates。
铁色素 ferrichrome是许多真菌产生的羟胺;肠杆菌素 enterobactin是大肠杆菌形成的邻苯二酚盐。似乎三个铁载体基团与铁形成六配位八面体复合物。
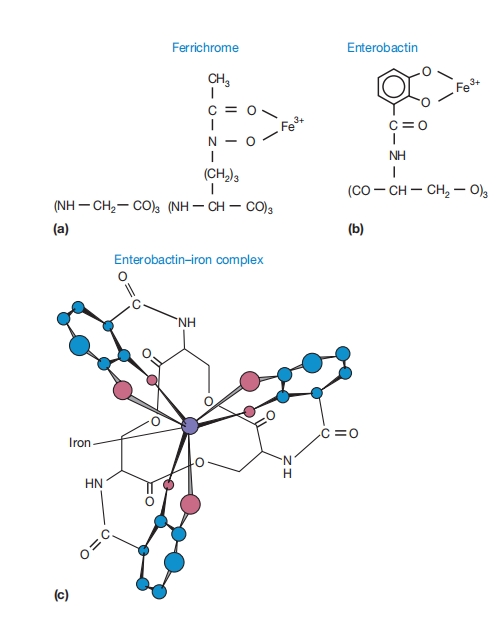
铁载体高铁铁复合物。(a)铁色素是许多真菌形成的环状羟胺[—CO—N(O⁻)—]分子。(b)大肠杆菌产生环状邻苯二酚盐衍生物肠杆菌素。(c)高铁铁可能与三个铁载体基团形成六配位八面体复合物,如本图所示的肠杆菌素-铁复合物。
当培养基中铁稀缺时,微生物分泌铁载体。一旦铁-铁载体复合物到达细胞表面,它就与铁载体受体蛋白 siderophore-receptor protein结合。
然后铁释放直接进入细胞,或者整个铁-铁载体复合物,通过ABC转运蛋白 ABC transporter,转运到内部。
在大肠杆菌中,铁载体受体位于细胞包膜的外膜中;当铁到达周质空间时,它在转运蛋白辅助下穿过质膜。铁进入细胞后,被还原为亚铁形式 ferrous form(Fe²⁺)。
铁对微生物如此关键,它们可能使用不止一种铁摄取途径,以确保充足供应。
参考文献
《Microbiology (Seventh Edition)》 | 微生物学,第七版
相关产品
| 货号 | 名称 | 价格 | 规格 |
|---|---|---|---|
| HZB875586 | 碎肉碳水化合物肉汤培养基 | 350 | 250g/瓶 |
| HZB875648 | 庖肉牛肉粒 | 230 | 100g/瓶 |
| HZB875647 | 氯化血红素 | 60 | 5ml/支(0.1mg/ml)、5支/盒 |
| HZB875646 | 维生素K1 | 50 | 5ml/支(1mg/ml)、5支/盒 |
| HZB875650 | L-半胱氨酸盐酸溶液 | 60 | 1ml/支(0.05g/ml),5支/盒 |
敬请关注灰藻生物,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2026-01-20
编制人:小藻
审稿人:小藻
