细菌浓度测量:麦氏比浊法详解及其与OD600、平板计数法的比较与操作
来源:武汉市灰藻生物科技有限公司 浏览量:5828 发布时间:2026-01-16 17:08:22
引言
麦氏比浊法(McFarland Turbidity Standard)是一种用于微生物学中定量测定细菌悬液浓度的标准方法。该方法通过硫酸钡(BaSO₄)悬液的浊度来模拟细菌悬液的浓度,从而间接估计细菌数量。麦氏比浊法广泛应用于临床微生物学、药敏试验(如Kirby-Bauer法)、疫苗制备及分子生物学实验中的细菌标准化培养。
一. 麦氏比浊法的原理及操作步骤
麦氏比浊法的核心原理是浊度与细菌浓度成正比。由不同比例的1%硫酸(H₂SO₄)和1.175%氯化钡(BaCl₂·2H₂O)反应生成硫酸钡沉淀,形成稳定的悬浊液。其浊度与特定浓度的细菌悬液(通常为1.5×10⁸ CFU/mL)相匹配,从而用于校准待测菌液的浓度。
标准麦氏比浊管通常分为0.5~4.0麦氏单位(McFarland Unit),不同数值对应不同的细菌浓度(见表1)。

表1 麦氏比浊法与细菌近似浓度

麦氏比浊法标准管样例
(一)标准比浊管的配制
麦氏比浊管可通过商业购买或实验室自行配制,配制方法如下:
(注:麦氏比浊标准管,推荐直接采购市场上的成品耗材,价格不高)
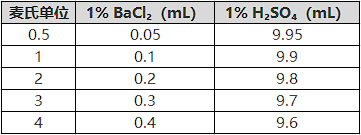
表2 麦氏比浊标准管
1.按比例混合1% BaCl₂和1% H₂SO₄于比色管中。
2.剧烈震荡混匀,形成稳定的硫酸钡悬浊液。
3. 储存于避光、密封条件下,有效期通常为6个月(长期存放可能沉淀,需重新混匀)。
(二)细菌悬液比浊测定
1.制备细菌悬液:取新鲜培养的菌落,用无菌生理盐水或肉汤培养基制成悬液。
2.比浊对照:将菌液与标准麦氏比浊管(如0.5麦氏单位)并列,在均匀光源(如比浊仪或白纸背景)下观察浊度。
3.调整浓度:
若菌液过浓,用生理盐水稀释。
若菌液过稀,离心后重悬或延长培养时间。
4.验证浓度(可选):
平板计数法:稀释菌液后涂布平板,培养后计算CFU。
分光光度法:测定OD₆₀₀值(通常0.5麦氏单位≈OD₆₀₀ 0.08~0.1)。
二. 麦氏比浊法的应用
1.药敏试验(Kirby-Bauer法)
调整菌液至0.5麦氏单位(≈1.5×10⁸ CFU/mL),确保药敏纸片扩散试验的准确性。
2.细菌接种标准化
在自动化血培养系统或PCR前处理中,需使用标准浊度的菌液以保证实验重复性。
3.疫苗和抗原制备
疫苗生产时需控制细菌浓度,麦氏比浊法可快速估算抗原量。
三. 麦氏比浊法的优缺点
1.优点
操作简便:无需复杂设备,适合基层实验室。
成本低:比浊管可长期保存,试剂廉价。
快速估算:适用于大批量样本的初步标准化。
2.局限性
精度较低:受主观视觉判断影响
适用于悬浮菌:不适用于沉淀或聚集的细菌(如链球菌、放线菌、链霉菌、诺卡氏菌属、丝状真菌等),事实上最广泛的应用场景是,肠道菌群中的各种细菌。
无法区分活菌/死菌:需结合平板计数法验证。
四. 麦氏比浊法的注意事项
比浊管需避光保存,防止硫酸钡沉淀。
菌液需充分混匀,避免细菌聚集影响浊度。
不同菌种差异:革兰氏阳性菌(如金黄色葡萄球菌)比阴性菌(如大肠杆菌)更易聚集,需额外均质化处理。
校准仪器:若使用分光光度计,需定期用标准比浊管校准。
五. 麦氏比浊法、分光光度法(OD600)与平板计数法的比较与操作详解
(一)分光光度法(OD600)与麦氏比浊法、平板计数法的关系
这三种方法均用于测定微生物悬液的浓度,但原理、精度和应用场景不同:
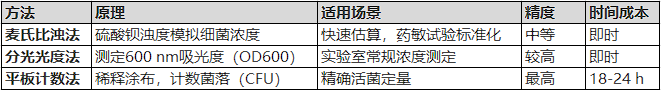
表3 麦氏比浊法和平板计数法
联系与区别:
麦氏比浊法和OD600均为间接测量,依赖浊度或吸光度,无法区分活菌/死菌。
平板计数法是直接计数活菌的金标准,但耗时较长。
OD600通常需要麦氏比浊法初步校准,而平板计数法可用于验证前两者的准确性。
(二)分光光度法(OD600)详解
1.原理
细菌悬液在600 nm波长下对光的散射和吸收与菌液浓度成正比。
OD600=1.0, 通常对应 1×10⁹ CFU/mL(因菌种而异,需校准)。
2.操作步骤
①空白调零:用培养基或生理盐水作为空白,设定分光光度计OD600归零,用中密度滤光片验证分光光度计的线性准确性。
②测定样本:取均匀菌液放入比色皿,测定OD600值(避免气泡干扰)。
③浓度计算:
通过标准曲线(OD600 vs CFU)换算浓度。
若无标准曲线,可参考经验值(如大肠杆菌OD600=0.1,近似浓度 ≈ 1×10⁸ CFU/mL)。
3.注意事项
线性范围:OD600通常仅在0.2~0.8之间呈线性,过高需稀释。
菌种差异:不同细菌大小/形状影响OD值(如球菌OD值通常高于杆菌)。
干扰因素:培养基颜色、颗粒杂质,需离心去除,用 PBS 重悬,或者选不干扰 600nm 波长的培养基。
(三)平板计数法(CFU计数)详解
1.原理
平板计数法是检测活菌的经典办法,观察菌落形成单位(CFU)数量估算浓度。一个 CFU 可能是单个细菌,也可能是聚在一起的细菌团。链状、簇状的细菌可能需特殊处理,只有能繁殖的活菌才能形成 CFU。
通过梯度稀释菌液,涂布于固体平板,培养后计数单菌落(CFU),计算原液浓度。
2.操作步骤
梯度稀释:取100 μL菌液加入900 μL无菌生理盐水(10⁻¹稀释),依次稀释至10⁻⁶~10⁻⁸。
涂布平板:取100 μL适宜稀释度菌液涂布于琼脂平板,每个稀释度做3个重复。
培养计数:倒置平板于37℃培养18-24 h,选择30~300 CFU的平板计数。
浓度计算:CFU/mL=平均菌落数×稀释倍数×10
注:(×10因涂布量为100 μL,换算为1 mL)。
3.注意事项
均质化:菌液需涡旋混匀,避免细菌聚集。
选择合适稀释度:过高稀释度导致无菌落,过低则菌落重叠。
厌氧菌/特殊菌:需特定培养条件(如CO₂培养箱、三气培养箱、厌氧培养箱)。
4.常见问题解答Q&A
Q1:OD600能否直接换算CFU?
• 厌氧菌的平板计数结果易偏低,推荐直接换算。而菌落明显的好氧菌,不推荐直接换算,建议先通过平板计数,建立标准曲线,对该菌浓度特性已经十分了解时,再进行直接换算。
Q2:麦氏比浊法为何用硫酸钡而非细菌本身?
• 硫酸钡悬液稳定,可长期保存,而细菌悬液易沉降或增殖。建议测量菌液麦氏浊度时,测量混匀时的瞬时值,而非静置后的数值。
Q3:平板计数为何选择30~300 CFU的平板?
• 小于30 统计误差大,大于 300 菌落重叠导致计数不准(“菌落拥挤效应”)。
总结
麦氏比浊法是一种经典的细菌浓度估算方法,尽管存在一定误差,但其简便性和低成本使其在微生物学实验中仍被广泛使用。结合分光光度法或平板计数法可进一步提高准确性,适用于科研、临床及工业微生物培养的标准化需求。
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-05-16
#创作团队
编制人:冬冬 | 审稿人:小藻
