实验指南 | 哺乳动物细胞原代培养与传代培养技术
来源:武汉市灰藻生物科技有限公司 浏览量:2063 发布时间:2024-05-16 13:44:31
一、实验目的
初步掌握哺乳动物细胞的原代培养与传代培养的基本操作过程,为活性化合物的筛选打下基础。
二、实验原理
从生物体中取出某种组织或细胞,模拟体内生理条件,在人工培养条件下使其生存、生长繁殖或传代,这一过程称为细胞培养。细胞培养技术的最大优点是使我们得以直接观察活细胞,并在能控制的环境条件下进行实验,避免了体内试验时的许多复杂因素,还可以与体内试验互为补充,可同时提供大量生物性状相同的细胞作为研究对象,耗费少,比较经济,因此成为生物学研究的重要手段。近年来,其在体细胞遗传、分化、胚胎发生、肿瘤发生、免疫学、细胞工程、放射生物学以及老年学等一系列的研究领域中得到广泛应用,并取得了丰硕的成果。
细胞培养可分为原代培养和传代(继代)培养。直接将从体内获取的组织细胞进行首次培养为原代培养;当原代培养的细胞增殖达到一定密度后,则需要做再培养,即将培养的细胞分散后,从一个容器以1:2或其他比例转移到另一个或几个容器中扩大培养,为传代培养。传代培养的累积次数就是细胞的代数。
细胞培养是一种程序复杂、要求条件多而严格的实验性工作。所有离体细胞的生长都受温度、渗透压、pH值、无机盐影响,消毒、配液等均有严格的规范和要求,特别是无菌操作是细胞培养成败的关键。
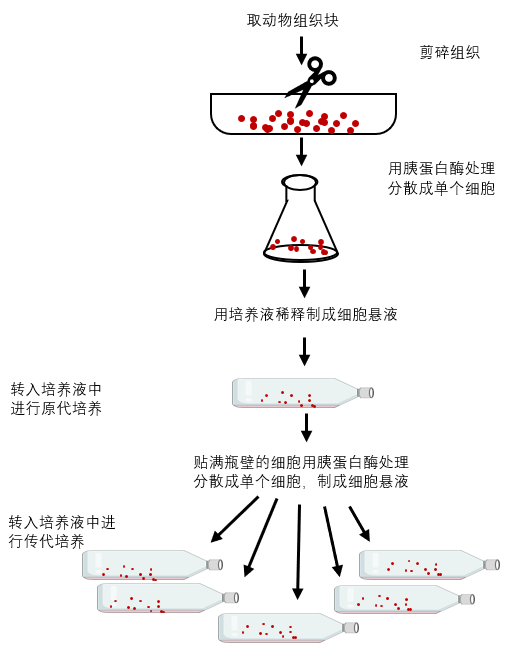
图1、细胞培养流程图
三、实验用品
(一)材料和标本
孕17天或新生SD大鼠海马细胞、HEK293、N2a等贴壁细胞。
(二)器材和仪器
手术器械、平皿、培养瓶、吸管、离心管(灭菌后备用)、酒精灯、烧杯、超净工作台、二氧化碳培养箱、倒置显微镜。
(三)试剂
含有10%胎牛血清的DMEM培养液、0.01mol/L PBS、0.25%胰蛋白酶-0.02%EDTA混合消化液、75%乙醇溶液。
四、实验方法
(一)原代细胞培养
1、原理 细胞培养(cell culture)是模拟机体内生理条件,将细胞从机体中取出,在人工条件下使其生存、生长、繁殖和传代,进行细胞生命过程、细胞癌变、细胞工程等问题的研究。近年来,其广泛地应用于分子生物学、遗传学、免疫学、肿瘤学、细胞工程等领域,发展成一种重要生物技术,并取得显著成就。由体内直接取出组织或细胞进行培养叫原代培养。原代培养细胞离体时间短,性状与体内相似,适用于研究。一般来说,幼稚状态的组织和细胞,如动物的胚胎、幼仔的脏器等更容易进行原代培养。
2、操作
1)溶液的配制
(1)磷酸盐缓冲液(PBS)(0.01 mol/L):KH2PO4,0.1g;Na2HPO4·12H2O,1.7 g;KC1,0.1 g;NaCl,4.0g;双蒸水加至 500 mL,pH值为 7.2~7.4。用0.2 μm滤膜过滤,4 ℃保存。
(2)1%胰蛋白酶的配制:用磷酸盐缓冲液(pH值为7.2~7.4)配制成浓度为1%的胰蛋白酶母液冻存。使用时,用解剖液稀释至0.25%。
(3)培养皿涂被多聚赖氨酸:配制0.01%的多聚赖氨酸,分装冻存。将上述多聚赖氨酸放入培养皿中,以覆盖底部为宜,2h后取出多聚赖氨酸,并用灭菌水洗2~3遍,自然晾干后备用。
(4)解剖液:葡萄糖,3.0g;蔗糖,7.5g;NaCl,8.0g;KCL,0.4 g;Na2HPO4·7H2O,0.18 g;KH2PO4 ,0.03 g;HEPES,2.14 g;加双蒸水1000 mL,调 pH 值为 7.0~7.4,过滤,4 ℃保存。
(5)种植液:DMEM89%,胎牛血清10%,谷氨酰胺培养液1%。
(6)培养液:neurobasal培养基,97%;谷氨酰胺培养液,1%;B-27,2%。
(7)阿糖胞苷:用双蒸水配制成浓度为1mg/mL的母液储存。用0.2μm滤膜过滤,-20℃储存。使用时,取6μL母液加入2mL培养液,终浓度为3μg/mL(根据实验情况调整浓度)。
2)取材及细胞裂解培养
(1)取新生SD大鼠(<12h)用75%乙醇溶液浸泡3~5min,将清洗完的乳鼠放入预冷的解剖液中,用2把尖镊去除鼠的头部皮肤和颅骨,剥离出全脑并将其放入另一盛有预冷解剖液的培养皿中。
(2)在解剖液中解剖大脑,分离出海马,移入另一盛有解剖液的培养皿中。在分离出全部的海马后,去除血管等组织,然后用剪刀将海马分成数小块,放入盛有0.25%胰蛋白酶的培养皿中,将培养皿放入37℃细胞培养箱消化10~15min。
(3)将培养皿中的海马碎片移入离心管中,去除含胰蛋白酶的液体并用种植液将海马碎片冲洗2~3遍,终止酶的消化作用。
(4)在离心管中加入2mL的种植液,用口径递减的吹打管轻轻吹打海马碎片数次,将上清液吸出备用,再加入2mL的种植液,用吸管吹打数次,将上清液吸出备用,如此反复数次,至海马碎片全部被吹打散开。每次吹打10下,吹打时注意不要吹入空气,吹打尽量轻柔。
(5)吸出的上清液再加入种植液调整其浓度,用200目细胞筛过滤。
(6)将上述滤过的液体混匀后分装入已涂有0.1mg/mL多聚赖氨酸的96孔板上,使分散的细胞计数约为0.3*10^6/mL。然后将96孔板放入5%的CO2,37℃细胞培养箱中培养。
(7)12h后观察细胞,镜下可见多数细胞贴壁生长。用生理盐水冲洗细胞2遍以上以去除细胞碎片,然后换上已平衡好的饲养液。
(8)培养36h后加入阿糖胞苷3μg/mL以抑制胶质细胞的分裂生长。
(9)加入阿糖胞苷后12h换液。以后每3天半量换液,饲养7~14天可以进行实验。
(10)或种板40min后,更换饲养液。这种方法细胞纯度高,但对细胞损害较大,需要较高培养技术。
(二)传代细胞培养
1、原理 体外培养的原代细胞或细胞株要在体外持续培养就必须传代,以便获得稳定的细胞株或得到大量的同种细胞,并维持细胞种的延续。培养的细胞形成单层汇合以后,由于密度过大生存空间不足而引起营养枯竭,将培养的细胞分散,从容器中取出,以1:2或1:3及以上的比例转移到另外的容器中进行培养,即为传代培养。
细胞一代指从细胞接种到分离再培养的期间,与细胞世代或倍增不同。在一代中,细胞倍增3~6次。细胞传代后,一般经过3个阶段:游离期、指数增生期和停止期。
常用细胞分裂指数表示细胞增殖的旺盛程度,即细胞群的分裂相数/100个细胞。一般细胞分裂指数介于0.2%~0.5%,肿瘤细胞可达3%~5%。细胞接种2~3天分裂增殖旺盛,是活力最好时期,称指数增生期(对数生长期),适宜进行各种实验。
2、操作
(1)将长成单层的原代培养细胞或HEK293细胞从二氧化碳培养箱中取出,在超净工作台中倒掉瓶内的培养液,加入少许消化液(以液面盖住细胞为宜),静置5~10min。
(2)在倒置显微镜下观察被消化的细胞,如果细胞变圆,相互之间不再连接成片,这时应立即在超净工作台中将消化液倒掉,加入3~5mL新鲜培养液,吹打,制成细胞悬液。
(3)将细胞悬液吸出2mL左右,加到另一个培养瓶中并向每个瓶中分别加3mL左右培养液,盖好瓶塞,送回二氧化碳培养箱中,继续进行培养。
3、结果 一般情况下,传代后的细胞在2h左右就能附着在培养瓶壁上,2~4天就可在瓶内形成单层,需要再次进行传代。
(三)器材及液体的准备和无菌操作的注意事项
1、器材和液体的准备
细胞培养用的玻璃器材,如培养瓶、吸管等在清洗干净以后,装在铝盒和铁筒中,120℃、2h干烤灭菌后备用;手术器材,瓶塞、配制好的PBS用灭菌锅138 kPa、20min蒸气灭菌;DMEM培养液、胎牛血清、消化液用G6滤器负压抽滤后备用。
2、无菌操作中的注意事项
在无菌操作中,一定要保持工作区的无菌清洁。为此,在操作前要认真洗手并用75%乙醇溶液消毒。操作前20~30min启动超净工作台吹风。操作时,严禁说话,严禁用手直接拿无菌的物品,如瓶塞等,而要用器械,如止血钳、镊子等去拿。培养瓶要在超净工作台内才能打开瓶塞,打开之前用乙醇将瓶口消毒,打开后和加塞前瓶口都要在酒精灯上烧一下,打开瓶口后的操作全部都要在超净工作台内完成。
操作完毕后,盖上瓶塞,才能拿到超净工作台外。使用的吸管在从消毒的铁筒中取出后要手拿末端,将尖端在火上烧一下,戴上胶皮乳头,然后再去吸取液体。总之,整个无菌操作过程都应该在酒精灯的周围进行。
总结
本文详细介绍了哺乳动物细胞原代培养与传代培养的基础实验操作流程,旨在帮助研究人员初步掌握这两种细胞培养技术,为活性化合物筛选等生物学研究奠定坚实的基础。实验从细胞培养的理论基础出发,阐述了其在科研中的重要性与应用领域,随后具体介绍了所需材料、仪器、试剂配制方法以及详细的实验步骤。通过以SD大鼠海马细胞为例的原代培养操作,以及HEK293细胞的传代培养实践,展示了细胞培养技术的全过程。此外,文章还强调了无菌操作的重要性,并提供了具体的操作规范,确保实验的成功实施。此指南不仅适用于初学者建立细胞培养技能,也为经验丰富的研究者提供了重要的参考信息。
参考文献:微生物天然药物化学研究
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2024-05-16
#创作团队
编制人:冬冬
