表皮葡萄球菌分类,生态特征,培养特性,致病性和临床表现
来源:武汉市灰藻生物科技有限公司 浏览量:1492 发布时间:2025-02-10 13:53:31
什么是表皮葡萄球菌?
表皮葡萄球菌是一种革兰氏阳性细菌,属于葡萄球菌属,是人类上皮细胞中最常分离的物种。
葡萄球菌是已知的簇状革兰氏阳性球菌,无鞭毛,不形成芽孢,兼性厌氧,主要分为两类:凝固酶阳性葡萄球菌和凝固酶阴性葡萄球菌。
表皮葡萄球菌属于凝固酶阴性葡萄球菌(CoNS)组,与凝固酶阳性葡萄球菌(如金黄色葡萄球菌)的区别在于其缺乏凝固酶。
它主要定植于腋窝、头部和前鼻孔,被认为能为这些可能恶劣环境的栖息地提供保护。
1884年,弗里德里希·尤利乌斯·罗森巴赫将这种细菌与金黄色葡萄球菌区分开来,最初命名为S. albus。后来于1916年由埃文斯重新命名。
表皮葡萄球菌大多数情况下是非致病性的,但可能会引起免疫系统受损患者的感染。因此,这些感染大多是医院获得性感染
它是人体正常菌群的一部分,栖息于皮肤表皮。
表皮葡萄球菌(Staphylococcus epidermidis)的分类
葡萄球菌属(Staphylococcus)的物种分类基于多种因素,如细胞壁的化学性质,特别是肽聚糖中肽桥的氨基酸组成和序列以及磷壁酸的组成。此外,葡萄球菌的其他生化特性也有助于物种的鉴别,包括在厌氧条件下生长时产生的乳酸。
以下是基于各种形态学、生理学和生化特性对表皮葡萄球菌(S. epidermidis)进行的分类学归类:
域:细菌域(Bacteria)
门:厚壁菌门(Firmicutes)
纲:芽孢杆菌纲(Bacilli)
目:芽孢杆菌目(Bacillales)
科:葡萄球菌科(Staphylococcaceae)
属:葡萄球菌属(Staphylococcus)
表皮葡萄球菌(Staphylococcus epidermidis)的栖息地
表皮葡萄球菌(S. epidermidis)是在人体来源的物质中发现的主要凝固酶阴性葡萄球菌种类。人类是这种微生物的唯一自然宿主。
表皮葡萄球菌的生理栖息地是人类和动物的皮肤和黏膜。其名称“epidermidis”即表明了该生物的栖息地。
从数量上来看,表皮葡萄球菌是人体皮肤上最常见的葡萄球菌种类。
它是人类皮肤和黏膜上无处不在的常驻微生物,是人类皮肤正常菌群的一部分,主要存在于鼻腔和身体易出汗的部位,如腋窝和背部。
它也是头皮、面部不同区域、腹股沟和腿部的主要常驻微生物。
哺乳动物皮肤中富含大量毛囊皮脂腺单位和汗腺的区域,以及身体表面开口周围的皮肤和黏膜上,发现了数量最多的皮肤葡萄球菌(10⁴–10⁶ CFU/cm²)。
作为正常菌群,该细菌的确切生理作用尚不清楚;然而,人们认为它可能参与皮肤的脂质代谢,并可能作为抵抗入侵微生物病原体的第一道屏障。
此外,这些细菌也被认为是导致由各种分泌物引起的体味的原因。
表皮葡萄球菌(Staphylococcus epidermidis)的形态
表皮葡萄球菌(S. epidermidis)是一种革兰氏阳性菌,在光学显微镜下呈球形,平均直径为0.5–1.5微米。老化培养物(>48小时)中的细胞通常呈革兰氏可变至近乎革兰氏阴性。
细胞在多个平面上分裂,形成不规则的双细胞、四细胞、短链集群和聚集体。
表皮葡萄球菌的细胞被认为存在细胞壁缺陷(L型),因此这些微生物无法进行革兰氏染色,对渗透压敏感,且不易在常规分离培养基上培养。
细胞膜是典型的脂质-蛋白质双层结构,主要由磷脂和蛋白质组成。磷脂、糖脂、类萜醌和类胡萝卜素构成细胞膜的主要脂质成分。
已知表皮葡萄球菌群中的某些成员在铁缺乏条件下表达特定的铁调节细胞膜蛋白。
此外,在该物种的某些成员中已检测到一种42kDa的细胞壁蛋白,该蛋白可结合人转铁蛋白(血清中的主要铁结合蛋白)。
细胞壁由肽聚糖和磷壁酸组成,其中肽聚糖是细胞壁中的主要结构聚合物,对维持细胞的球形结构起着至关重要的作用。
在表皮葡萄球菌中还观察到少数壁相关蛋白,其中一些是纤连蛋白结合蛋白。
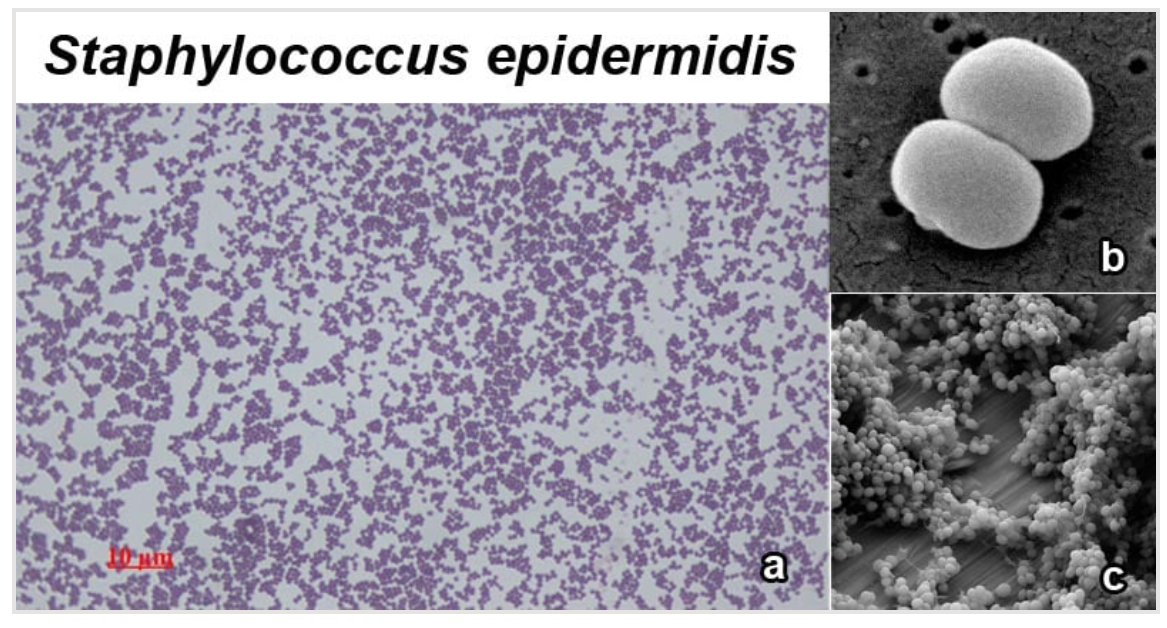
图:a. 表皮葡萄球菌在明场显微镜下的1000倍放大图像;b. 表皮葡萄球菌的扫描电子显微镜图像;c. 钛基底上的表皮葡萄球菌生物膜。
表皮葡萄球菌(Staphylococcus epidermidis)的培养特性
葡萄球菌能在多种商业用、选择性和非选择性琼脂培养基上产生独特的菌落。
常用的选择性培养基包括甘露醇盐琼脂、脂肪酶盐甘露醇琼脂、苯乙醇琼脂、哥伦比亚考利斯汀-萘啶酸(CNA)琼脂以及添加了蛋黄亚碲酸盐增菌剂的巴氏-帕克琼脂基础培养基。
同一菌株的菌落通常表现出大小、质地、边缘、轮廓、光泽和色素等相似特征,但有些菌株可能会产生两种或多种形态类型。
特别是表皮葡萄球菌,PIA编码基因的可变表达被认为是导致同一菌株间形态差异的原因。
以下是表皮葡萄球菌在不同琼脂培养基上的菌落形态:
在营养琼脂上,观察到表皮葡萄球菌形成圆形、奶油色至白色的菌落。菌落直径大多为1毫米,边缘完整。菌落隆起,中心密集,边缘透明。
甘露醇盐琼脂(MSA)
在甘露醇盐琼脂上形成小粉色至红色菌落。由于细菌不能发酵甘露醇,培养基保持红色。
这种培养基是金黄色葡萄球菌的选择性培养基,常用于区分金黄色葡萄球菌和表皮葡萄球菌。
胰蛋白胨大豆琼脂(TSA)
在胰蛋白胨大豆琼脂上,表皮葡萄球菌产生白色隆起、直径为1-2毫米的凝聚性菌落。
已知某些表皮葡萄球菌菌株还会产生淡紫色、粉红色或褐色色素。
刚果红琼脂(CRA)
在刚果红琼脂上,观察到淡粉色至红色、不透明、质地粗糙且中央有乳头的菌落。
表皮葡萄球菌的毒力因子
尽管表皮葡萄球菌(S. epidermidis)并未进化为致病微生物,但它现在却经常与各种医院内感染相关联。该微生物还具有多种机制来逃避宿主免疫系统的吞噬和杀灭。在感染过程中,保护该微生物免受宿主免疫防御的一些机制和产物包括:
1.生物膜形成
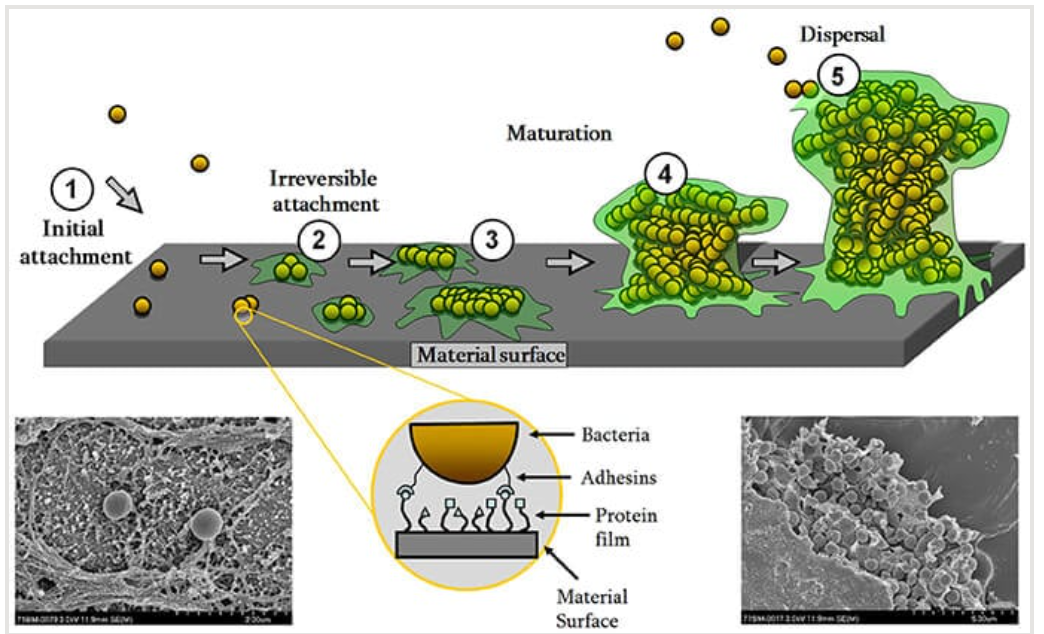
图:钛表面表皮葡萄球菌(S. epidermidis)单细胞(左下方)或被胞外聚合物(EPS)包围的生物膜群落(右下方)的扫描电子显微镜图像。
生物膜形成是表皮葡萄球菌导致各种获得性感染的最重要毒力因子。它支持微生物的定植、免疫逃避以及抗生素耐药性。
生物膜是由微生物产生的或被环境衍生的胞外基质包裹的多细胞聚集体。
生物膜的形成为微生物提供了优势,使其能更好地适应环境因素,并增强了对抗恶劣条件的抵抗力。
生物膜的形成通过两个步骤实现:首先是细菌的初始附着,随后是细菌的聚集和成熟为多细胞结构。
表皮葡萄球菌具有表面蛋白,如AtlE,这是一种双功能黏附素/自溶素,以及Bap/Bhp蛋白,有助于细菌黏附到生物和非生物表面。
此外,表皮葡萄球菌还具有各种被称为MSCRAMM(微生物表面成分识别黏附基质分子)的表面蛋白,这些蛋白能够与基质蛋白相互作用并支持定植。
表皮葡萄球菌最重要的MSCRAMM是SdrG(Fbe),一种纤维蛋白原结合蛋白,它对于促进表皮葡萄球菌在皮肤表面的纤维蛋白原上黏附是必要且充分的。
初始黏附后,生物膜通过由许多不同的表面大分子介导的细胞间聚集而发展,如聚-N-乙酰葡糖胺(PNAG)同聚物,也被称为PIA(多糖细胞间黏附素)。
2.保护性胞外聚合物
表皮葡萄球菌产生胞外聚合物,即聚-γ-谷氨酸(PGA)和PNAG/PIA,这些聚合物能保护细菌免受宿主先天防御机制的重要攻击。
已发现这种胞外多糖还能保护表皮葡萄球菌免受中性粒细胞的杀灭、补体沉积和免疫球蛋白的攻击。
3.病原体相关分子模式
此外,还发现一些特定于表皮葡萄球菌的分子能够刺激宿主先天防御,因此它们作为病原体相关分子模式(PAMPs)发挥作用。
据报道,PNAG/PIA能够刺激Toll样受体2,这体现了病原体与宿主之间躲猫猫式相互作用的有趣例子,因为表皮葡萄球菌用于免疫逃避的物质会触发宿主先天防御机制。
表皮葡萄球菌的发病机理
已发现表皮葡萄球菌(Staphylococcus epidermidis,S. epidermidis)在特定患者群体中引起侵袭性感染,这些患者包括早产儿、免疫功能低下者以及体内植入永久性医疗器械的患者。表皮葡萄球菌引起的感染的发病机理可解释如下:
1.黏附/附着/定植
作为一种共生微生物,表皮葡萄球菌保留了专门黏附于皮肤宿主蛋白的能力。
在手术伤口中,该细菌利用这些黏附机制黏附于深层组织和植入物上。
细菌最初对植入物表面的黏附是通过非特异性相互作用介导的,这些相互作用由特定的黏附素(如自溶素和细胞外DNA)介导。
在医疗器械的背景下,器械表面在随后的黏附发生后立即被宿主来源的血浆蛋白、细胞外基质蛋白和凝血产物(血小板和凝血酶)覆盖。
初始黏附之后是不可逆的附着,这是由纤维蛋白原结合蛋白SdrG(Fbe)引起的,它促进表皮葡萄球菌与皮肤表面的纤维蛋白原结合。
在医疗器械的情况下,壁磷壁酸通过与吸附的纤连蛋白结合,增强了表皮葡萄球菌对医疗器械的初始黏附
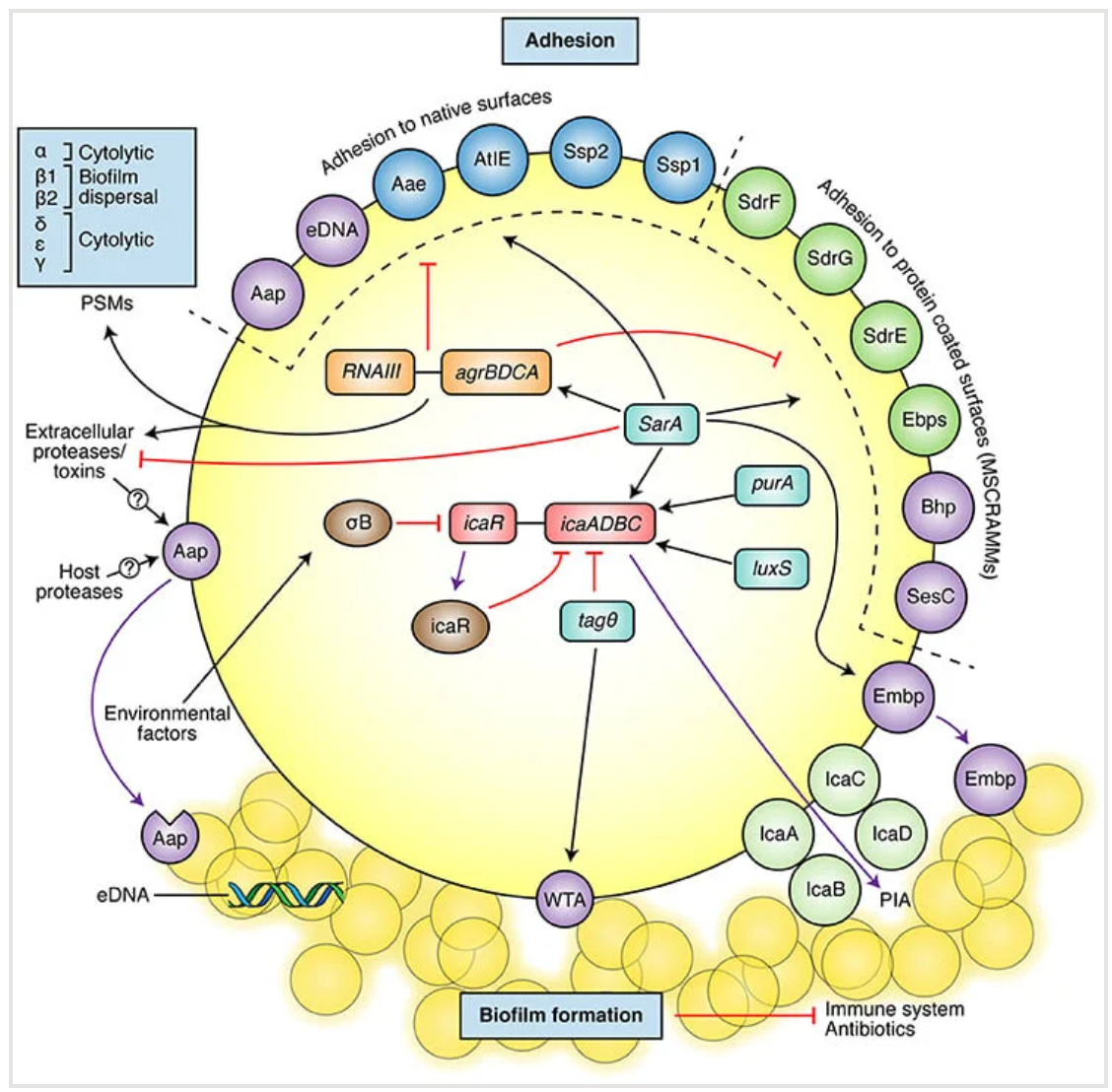
表皮葡萄球菌主要致病机制示意图,包括黏附分子和生物膜形成。上半部分展示了参与黏附于天然表面或蛋白质覆盖表面的最著名的黏附素(也参与生物膜形成的分子以紫色显示)。图示底部展示了主要的生物膜成分(PIA、切割的Aap、eDNA、WTA和Empb)。图示还展示了一些最重要的生物膜和黏附分子调节因子(黑色箭头:激活/正信号,红色线条:抑制/负信号)。
2.生物膜形成
细菌对生物和非生物表面的初始黏附是生物膜形成的第一步,也是该生物体最重要的毒力因子。
表皮葡萄球菌生物膜的积累和成熟是通过多种机制发生的。
多糖胞间黏附素(PIA,或多聚N-乙酰葡糖胺,PNAG)在大多数表皮葡萄球菌分离株中负责生物膜的形成。
然而,在其他分离株中,生物膜的形成是由蛋白质类因素引起的,如积累相关蛋白(Aap)。
生物膜在免疫逃避中发挥作用,主要是通过为免疫细胞提供屏障。
此外,PIA通过促进补体C5a片段的生成、抑制吞噬细胞和中性粒细胞的杀伤作用,以及降低抗菌肽(AMPs)的活性,从而有助于逃避先天免疫系统。
生物膜内的细菌细胞被包裹在多糖基质中,这使得细菌种群能够逃避宿主的防御机制和抗菌药物的作用。
3.分散
一旦生物膜形成,其中的细菌往往会分散到新的继发感染部位。
成熟生物膜的特征性结构,如蘑菇状形态和通道,依赖于细胞间破坏性因子的产生,在表皮葡萄球菌中,这些因子是酚溶性调制蛋白(PSMs)。
这些表面活性剂样的分子可能通过减少细胞间的非共价黏附来发挥作用,从而导致与生物膜相关的感染传播。细胞或细胞簇可能从生物膜上脱落,到达继发感染部位。
生物膜相关感染引起的临床症状大多是由于宿主对生物膜释放的抗原产生的免疫反应所致。
然而,宿主的免疫反应可能会对周围组织造成更多损伤,而不是清除生物膜。
表皮葡萄球菌的临床表现
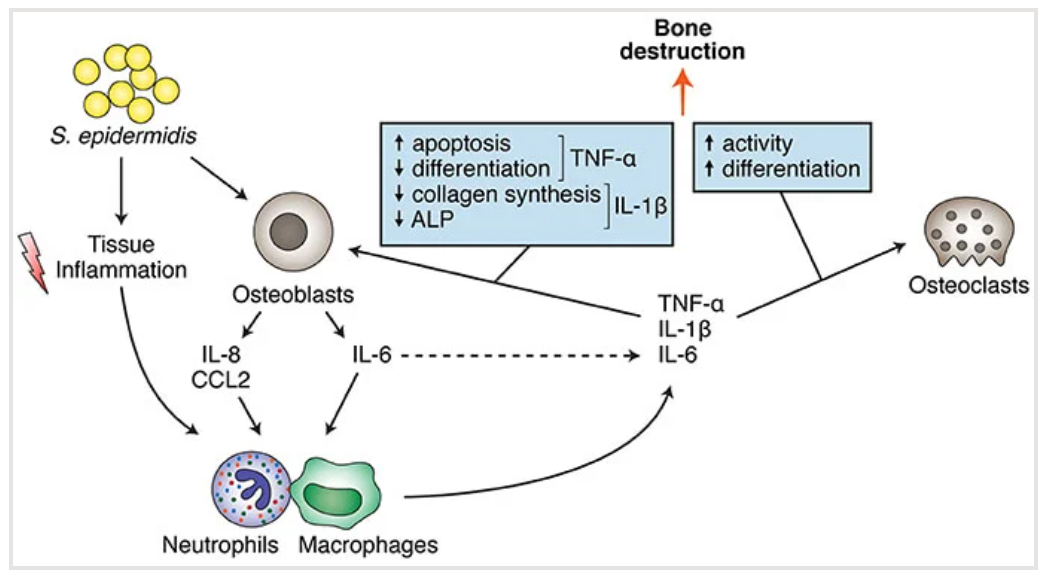
图示:表皮葡萄球菌对骨细胞(成骨细胞和破骨细胞)的直接和间接影响,导致骨破坏。
表皮葡萄球菌主要与院内感染相关,这类感染主要与永久性医疗植入装置(如导管)有关。
该细菌与超过22%的中心静脉导管血流感染相关。
此外,这种微生物可能在分流术、人工关节、血管移植物和手术部位感染中发挥重要作用。
受污染的隐形眼镜引起的角膜炎和眼内炎、导尿管感染、菌血症、纵隔炎和其他感染也与表皮葡萄球菌有关。
表皮葡萄球菌感染很少致命,但它们会显著增加发病率和医疗保健成本。
其他感染包括肺炎、深部脓肿、骨髓炎、心内膜炎、静脉炎、乳腺炎和脑膜炎,这些感染通常与住院患者相关,而非社区中的健康个体。
表皮葡萄球菌的实验室诊断
与大多数细菌感染一样,收集临床标本是实验室诊断的第一步。在表皮葡萄球菌的情况下,需要收集的临床标本包括痂皮、关节穿刺液以及从深层部位抽取的脓液。表皮葡萄球菌感染疾病的诊断主要与鉴定该病原体有关。下面列出了一些鉴定方法:
1.显微镜观察与生化试验
对这些标本进行直接显微镜检查,可以迅速得出疑似报告,观察到类似葡萄球菌的革兰氏阳性球菌。
直接观察后,将标本接种于选择性培养基(如添加5%绵羊血的胰蛋白胨大豆琼脂培养基)上,在35–37°C的空气中孵育18–24小时,以分离出病原体。
可以通过观察培养基上的菌落来进行初步鉴定。随后,可以对分离出的菌落进行各种生化试验。
根据显微镜观察结果、菌落形态和生化试验,可以检测出表皮葡萄球菌。
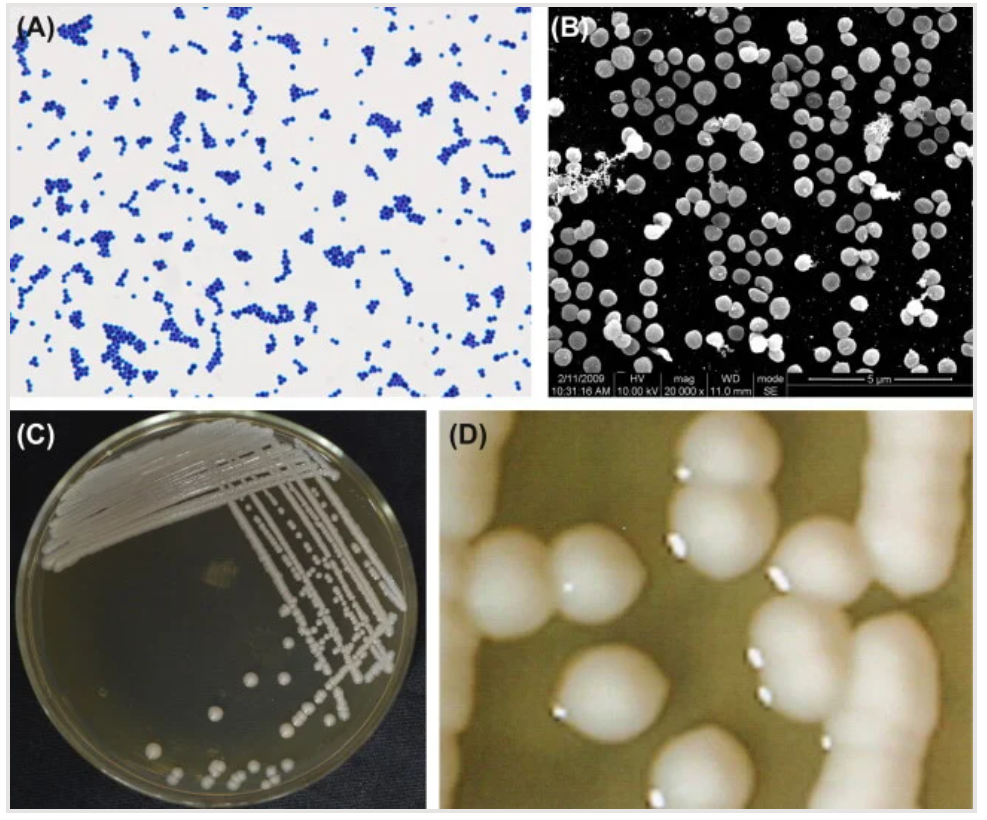
图:(A) 表皮葡萄球菌细胞(革兰氏染色)。(B) 表皮葡萄球菌细胞(扫描电子显微镜图)。表皮葡萄球菌细胞呈球形(直径0.5–1.5微米),为革兰氏阳性菌。这些球菌排列成四联体和簇状。偶尔也会观察到单个细胞。(C) 在琼脂平板上孵育的表皮葡萄球菌菌落。(D) 表皮葡萄球菌菌落(体视显微镜图)。图片来源:《口腔微生物图谱》。
2.快速鉴定试剂盒
可以发现多种快速鉴定试剂盒和自动化系统,它们能够在数小时至一天内准确鉴定出70–90%的大多数物种和亚种。
这些试剂盒基于多种因素,如抗生素敏感性、酶的产生、免疫反应和细胞脂肪酸分析。
3.分子方法
分子方法通常包括在分子水平上帮助鉴定病原体的检测。
其中最重要的分子方法之一是聚合酶链反应(PCR),它有助于扩增和检测细菌DNA。
此外,还可以进行DNA测序,以确定细菌的DNA序列,然后用于其鉴定。
另一种重要且成功的诊断方法是应用限制性片段长度多态性(RFLP)方法分析核糖体RNA。
表皮葡萄球菌的治疗
由于大多数表皮葡萄球菌感染与医疗植入装置有关,因此移除这些装置是治疗的首要方法。
其他体外感染可通过使用抗生素药物进行治疗,包括头孢菌素类药物,如头孢唑林、奈夫西林或苯唑西林。
对于严重感染或抗生素耐药菌株,万古霉素是治疗这些感染的首选药物。
尽管进行了抗生素治疗并消除了相关感染因素,但医疗植入装置感染对抗菌药物具有极强的耐药性。
目前正在采用新方法寻找一系列针对不同分子的新型抗菌药物。已确定潜在靶点,如参与重要功能的酶,并开发了筛选方法来鉴定特定靶标分子的抑制剂。
还在研究其他治疗方法,包括使用来自人类捐赠者的超免疫血清或针对表面成分的人源化单克隆抗体。
预防表皮葡萄球菌感染
细菌生物膜对抗菌药物的固有耐药性,以及耐药菌株数量的不断增加,表明需要采取有效的预防策略。以下是一些可遵循的预防策略,以避免此类感染:
可使用生物材料涂层或在出口部位使用敷料,以预防与医疗设备相关的感染。
定期清洁和包扎伤口也可能在一定程度上预防葡萄球菌感染。
在插入过程中,使用无菌技术防止细菌从插入部位和导管集线器污染,也是一种有效的预防方法。
参考资料:
Topley WWC (2007). Topley and Wison’s Microbiology and Microbial Interactions; Bacteriology, 2 Vol. Tenth Edition. John Wiley and Sons Ltd.
Hildegunn Norbakken Granslo, Claus Klingenberg, Elizabeth Gladys Aarag Fredheim, Arild Rønnestad, Tom Eirik Mollnes, Trond Flægstad. The Arginine Catabolic Mobile Element is associated with low antibiotic resistance and low pathogenicity in Staphylococcus epidermidis from neonates. Pediatric Research 2010; 68: 237-41
Elizabeth G. Aarag Fredheim, Hildegunn Norbakken Granslo, Trond Flægstad, Yngve Figenschau, Holger Rohde, Irina Sadovskaya, Tom Eirik Mollnes, Claus Klingenberg. Staphylococcus epidermidis Polysaccharide Intercellular Adhesin Activates Complement FEMS Immunology and Microbiology 2011; 63: 269–280
Hildegunn Norbakken Granslo, Claus Klingenberg, Elizabeth Aarag Fredheim, Ganesh Acharya, Tom Eirik Mollnes, Trond Flægstad. Staphylococcus epidermidis biofilms induce lower complement activation in neonates compared to adults. Submitted to Infection and Immunity October 27th 2011.
Peters G., Schumacher-Perdreau F., Jansen B. (1990) Staphylococcus epidermidis— a Versatile Pathogen. Pathogenesis of Wound and Biomaterial-Associated Infections. Springer, London. https://doi.org/10.1007/978-1-4471-3454-1_37
Otto, M. Staphylococcus epidermidis— the ‘accidental’ pathogen. Nat Rev Microbiol 7, 555–567 (2009). https://doi.org/10.1038/nrmicro2182
Namvar A E et al (2014). Clinical characteristics of Staphylococcus epidermidis: a systematic review. GMS Hyg Infect Control. 2014; 9(3): Doc23.
Deighton, M., Capstick, J., & Borland, R. (1992). A study of phenotypic variation of Staphylococcus epidermidis using Congo red agar. Epidemiology and Infection,109(3), 423-432. doi:10.1017/S095026880005041X
BRUCE E. LANGLOIS, ABDUL KARIM PARLINDUNGAN, ROBERT J. HARMON, KATHERINE AKERS; Biochemical Characteristics of StaphylococcusSpecies of Human and Bovine Origin. J Food Prot 1 February 1990; 53 (2): 119–126. doi: https://doi.org/10.4315/0362-028X-53.2.119
Sabaté Brescó Marina, Harris Llinos G., Thompson Keith, Stanic Barbara, Morgenstern Mario, O’Mahony Liam, Richards R. Geoff, Moriarty T. Fintan. Pathogenic Mechanisms and Host Interactions in Staphylococcus epidermidis Device-Related Infection. Frontiers in Microbiology. 8. 2017. Pg: 1401. 10.3389/fmicb.2017.01401
Paulus H. S.Kwakman, Anje A. te Velde, Christina M. J. E. Vandenbroucke-Grauls, Sander J. H. van Deventer, Sebastian A. J. Treatment and Prevention of Staphylococcus epidermidis Experimental Biomaterial-Associated Infection by Bactericidal Peptide 2. Antimicrobial Agents and Chemotherapy Nov 2006, 50 (12) 3977-3983; DOI: 10.1128/AAC.00575-06
Foster T. Staphylococcus. In: Baron S, editor. Medical Microbiology. 4th edition. Galveston (TX): University of Texas Medical Branch at Galveston; 1996. Chapter 12.Available from: https://www.ncbi.nlm.nih.gov/books/NBK8448/
Doškař J., Pantůček R., Růžičková V., Sedláček I. (2010) Molecular Diagnostics of Staphylococcus aureus. In: Viola Magni M. (eds) Detection of Bacteria, Viruses, Parasites and Fungi. NATO Science for Peace and Security Series A: Chemistry and Biology. Springer, Dordrecht. https://doi.org/10.1007/978-90-481-8544-3_7
Gaszewska-Mastalarz A, Mordarski M, Zakrzewska-Czerwińska J. Molekularna diagnostyka mikroorganizmów–identyfikacja Staphylococcus epidermidis [Diagnostic molecular microbiology–identification of Staphylococcus epidermidis]. Postepy Hig Med Dosw. 1998;52(1):19-34.
O’gara JP and Humphreys H (2001). Staphylococcus epidermidis biofilms: importance and implications. J. Med. Microbiol. Vol. 50 (2001). 582-587.
敬请关注“灰藻视界”,共筑健康未来!
— 武汉市灰藻生物科技有限公司团队敬上
灰藻生物:我们期待着与客户共同成长,共创生命科学的美好未来!
更新日期:2025-02-07
#创作团队
编制人:木木
